
| A. | 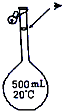 定容 | B. |  钠的焰色反应 | ||
| C. |  蒸馏 | D. |  蒸发 |
分析 A.定容时眼睛应该平视容量瓶刻度线;
B.观察钾的焰色反应要通过钴玻璃;
C.蒸馏时冷凝水应从下口进上口出;
D.蒸发时防止迸溅要用玻璃棒搅拌.
解答 解:A.定容时应平视容量瓶的刻度线,图中为俯视定容,造成加水偏少,所配浓度偏高,故A错误;
B.观察钾的焰色反应要通过钴玻璃,滤去钠的黄色,避免干扰,图示是进行钠的焰色反应实验,不能使用蓝色钴玻璃,否则看不到钠的焰色反应,故B错误;
C.蒸馏时冷凝水应该采用逆向通水,冷凝效果较好,即:从下口进上口出,故C错误;
D.蒸发时防止迸溅要用玻璃棒搅拌,图示装置合理,故D正确;
故选D.
点评 本题考查了常见化学实验操作方法,题目难度中等,明确化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.12mol•L-1 | C. | 0.05mol•L-1 | D. | 0.16mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
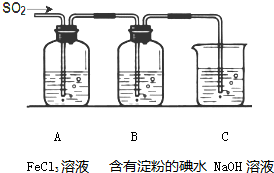 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 硫酸氢钠属于盐类,其水溶液显中性 | |
| D. | 碳酸氢钠可以用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素均可以和氧元素形成2种或2种以上氧化物 | |
| B. | 实验室用铜和浓硝酸反应制取NO | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐溶液是电解质 | |
| B. | 溶液和胶体的本质区别是有无丁达尔效应 | |
| C. | 可用NaOH溶液回收铝合金中的镁 | |
| D. | 小苏打溶液呈碱性的原因:HCO3-?OH-+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
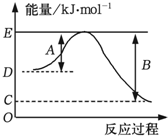 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com