
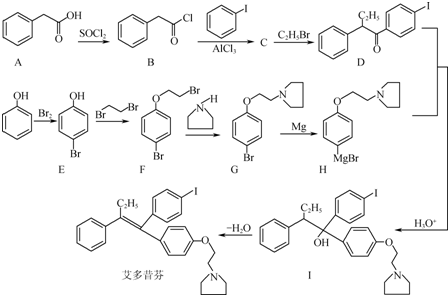
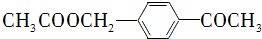 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
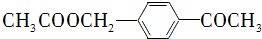 ,先将乙酸生成CH3COCl,可能参照题中A→B的过程,再在甲苯的对位上引入-COCH3基团,可以参照题中合成路线中的B→C的过程,得到
,先将乙酸生成CH3COCl,可能参照题中A→B的过程,再在甲苯的对位上引入-COCH3基团,可以参照题中合成路线中的B→C的过程,得到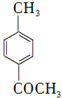 ,再在甲基上卤代、碱性水解引入羟基、再与乙酸酯化得
,再在甲基上卤代、碱性水解引入羟基、再与乙酸酯化得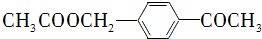 ,据此设计合成路线;
,据此设计合成路线;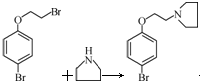 +HBr,
+HBr, +HBr;
+HBr; ,
, ;
;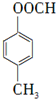 ,
, ;
;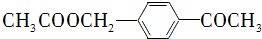 ,先将乙酸生成CH3COCl,可能参照题中A→B的过程,再在甲苯的对位上引入-COCH3基团,可以参照题中合成路线中的B→C的过程,得到
,先将乙酸生成CH3COCl,可能参照题中A→B的过程,再在甲苯的对位上引入-COCH3基团,可以参照题中合成路线中的B→C的过程,得到 ,再在甲基上卤代、碱性水解引入羟基、再与乙酸酯化得
,再在甲基上卤代、碱性水解引入羟基、再与乙酸酯化得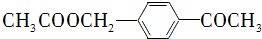 ,据此设计合成路线为
,据此设计合成路线为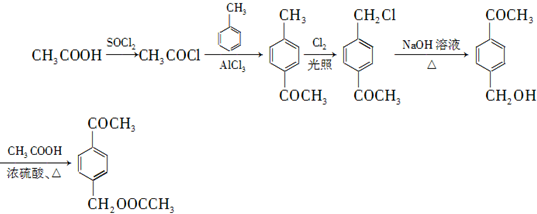 ,
, ;
;


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| CI2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
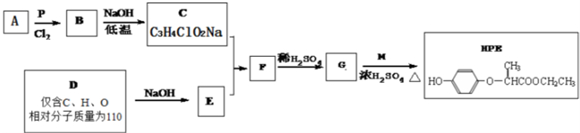
| P |
| Cl2 |
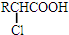
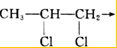
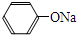 +RCl→
+RCl→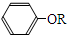 +NaCl
+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
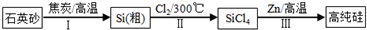
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
验证氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | ||
| ② |
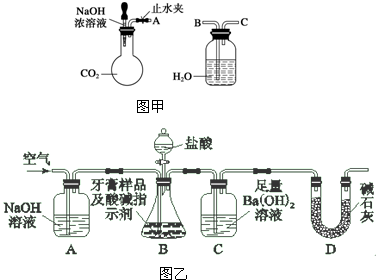
查看答案和解析>>
科目:高中化学 来源: 题型:
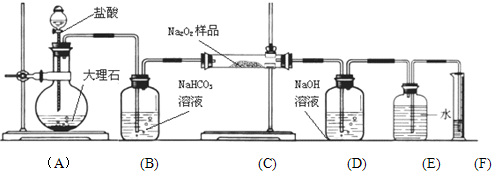
查看答案和解析>>
科目:高中化学 来源: 题型:
 ).
).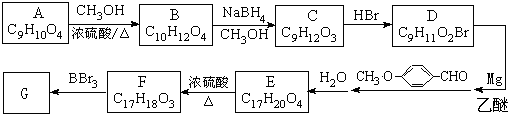
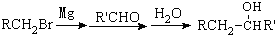
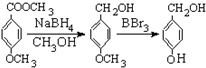
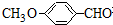 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com