

图2-14
A.锌和盐酸发生氢气 B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳 D.氯化钠和浓硫酸生成氯化氢
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
图2-14
A.锌和盐酸发生氢气 B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳 D.氯化钠和浓硫酸生成氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
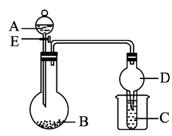
图1-5-14
(1)若A为浓硫酸;B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液。实验中观察到溶液褪色,则B是_____________(写化学式),B与浓H2SO4反应的化学方程式为_____________。反应后往烧杯中加入沸水,又可观察到试管C中的现象为__________________________。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是____________________。然后往烧杯中加入沸水,可观察到试管C中的现象是___________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_____________ (写名称),C是_____________ (写化学式)与葡萄糖的混合液。该反应的离子方程式为_____________,仪器D在此实验中的作用是__________________________。
查看答案和解析>>
科目:高中化学 来源:江苏月考题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com