
��12�֣� A��B��C��D��F�������ʵ���ɫ��Ӧ��Ϊ��ɫ��A��B��C��D�����ᷴӦ������E������B������һ�ֿ�ȼ���塣��C��D������һ����ɫ��ζ����H����������ʹ����ʯ��ˮ����ǡ�D��A�ɷ�Ӧ����C��F��HҲ�ɷ�Ӧ����C����һ����ɫ��ζ���塣��ش��������⣺
��1��д��A��C��F�Ļ�ѧʽ��A �� C �� F ��
��2��д��C��Һ��H��Ӧ�Ļ�ѧ����ʽ ��
��3��д�����з�Ӧ�����ӷ���ʽ��
�� D+���� ���� B+ˮ ��
��1��NaOH��Na2CO3��Na2O2����2��Na2CO3+CO2 +H2O= 2NaHCO3��
��3����HCO3- + H+ = CO2��+H2O �� 2Na+2H2O = 2Na+ + 2OH-+ H2����
�������������A��B��C��D��F�������ʵ���ɫ��Ӧ��Ϊ��ɫ��˵�����������ʾ�����NaԪ�ء�B�����ᷴӦ����һ�ֿ�ȼ���壬��B��Na��C��D�����ᷴӦ����һ����ɫ��ζ����H����������ʹ����ʯ��ˮ����ǣ�˵��C��DΪNa2CO3��NaHCO3����֪D��A�ɷ�Ӧ����C������A��NaOH��C��Na2CO3��D��NaHCO3��F��HҲ�ɷ�Ӧ����C����һ����ɫ��ζ���壬�ܹ�����Na2CO3����ɫ��ζ����ĺ���Ԫ�صĻ�����ֻ��Na2O2��CO2��Ӧ������F��Na2O2��H��CO2��
���㣺Ԫ�ػ������ƶ�
��������������Խ�ǿ���ѶȽϴdz�ѵ��ѧ���ķ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| D�ĵ��� |
| D�ĵ��� |
| H2O |
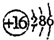
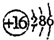


| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��� | Ԫ�� | �ṹ������ | ||
| �� | A | A�ĵ���������ˮ���ҷ�Ӧ������ǿ������Һ�к������ֵ�������ͬ������������ | ||
| �� | B | Bԭ���������������ڲ����������
| ||
| �� | C | C�����������������������Ϊ�ͻ���� | ||
| �� | D | A��D��E��ɵ�36���ӵĻ�������Ǽ�������������Ҫ�ɷ� | ||
| �� | E | ͨ������£�Eû�������ϼۣ�A��B��C��D��F������E�γɻ����� | ||
| �� | F | FԪ���������������۵Ĵ�����Ϊ4 |
| ʵ���� | �¶�/�� | �����Լ� | ����Y���� |
| �� | 5 | 2�� 1mol/L FeCl3��Һ | 4mL 10% ��Y��Һ |
| �� | 40 | 2��1mol/L FeCl3��Һ | 4mL 10% ��Y��Һ |
| �� | 40 | 2��1mol/L FeCl3��Һ 2mL X |
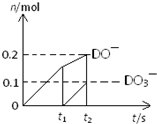
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com