
【题目】下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液强
B. 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠物质的量等于醋酸所需氢氧化钠物质的量
C. 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的![]()
D. 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
【答案】B
【解析】A.电解质强弱与导电能力无关,与自由移动离子浓度成正比,强电解质导电能力不一定强,弱电解质导电能力不一定弱,电解质溶液导电能力与自由移动离子浓度成正比,故A错误;B.醋酸在水溶液中部分电离,是弱电解质;盐酸是强酸,完全电离,但等体积等物质的量浓度的醋酸和盐酸,它们的物质的量相同,故中和等体积等物质的量浓度的醋酸和盐酸时,消耗的氢氧化钠的物质的量相等,故B错误;C.一水合氨为弱电解质,加水促进电离,将氢氧化钠溶液和氨水溶液各稀释一倍,氨水的OH-浓度大于原来的![]() ,故C错误;D.因醋酸是弱酸,盐酸中的c(H+)远远超过醋酸中c(H+)的两倍,故D错误;答案为B。
,故C错误;D.因醋酸是弱酸,盐酸中的c(H+)远远超过醋酸中c(H+)的两倍,故D错误;答案为B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A. 滴定前酸式滴定管需用盐酸标准液润洗
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是![]()
![]()
A.水电离的![]() :①=②=③=④
:①=②=③=④
B.等体积的①、②、④溶液分别与足量铝粉反应,生成![]() 的量:①最大
的量:①最大
C.若将②、③溶液混合后,混合液的![]() ,则消耗溶液的体积:②=③
,则消耗溶液的体积:②=③
D.向溶液中加入100mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,将![]() 的醋酸溶液稀释到原体积的10倍后,溶液的
的醋酸溶液稀释到原体积的10倍后,溶液的![]()
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.![]() 时,用醋酸溶液滴定等浓度NaOH溶液至
时,用醋酸溶液滴定等浓度NaOH溶液至![]() ,
,![]() 醋酸
醋酸![]()
D.在![]() 溶液中加入适量
溶液中加入适量![]() ,可使
,可使![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molN2与4mol H2混合充分反应,则反应中转移的电子数目为6mol
B.反应2Mg(s)+CO2(g)=C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C.向0.1mol·L1 CH3COONa溶液中加入少量水,溶液中 减小
减小
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )
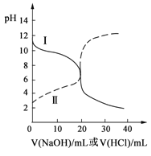
A.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>”、“<”或“=”);
(2)25℃时,pH之和为14的CH3COOH溶液与NaOH溶液混合,充分反应后溶液显中性,则所耗溶液的体积前者_______后者(填“>”、“<”或“=”);
(3)若用NaOH标准溶液滴定未知浓度的醋酸,选择的指示剂应为_______;
(4)下列离子CH3COO-、CO32-、HCO3-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )

A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com