
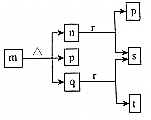
 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )| A. | 离子半径:W+>Z2- | |
| B. | Y的非金属性强于Z,故YX4的热稳定性强于q | |
| C. | n和少量t反应生成m,m还可以和t反应生成p和q | |
| D. | 把少量r投入到FeSO4溶液中,产生无色气体和白色沉淀 |
分析 三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,则X应为H元素,q为无色透明液体,应为H2O,s可使带火星的木条复燃,应为O2,由转化关系可知r为Na2O2,则n为CO2,则p为Na2CO3,m为NaHCO3,t为NaOH,由此可知Y为C、Z为O、W为Na元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为H元素,Y为C、Z为O、W为Na元素,p为Na2CO3,q为H2O,m为NaHCO3,t为NaOH,r为Na2O2,n为CO2,s为O2,
A.Z为O、W为Na元素,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,故A错误;
B.非金属性C<O,故B错误;
C.二氧化碳和少量氢氧化钠反应可生成碳酸氢钠,碳酸氢钠和氢氧化钠继续反应,可生成碳酸钠和水,故C正确;
D.过氧化钠具有强氧化性,可硫酸亚铁反应生成氢氧化铁沉淀,为红褐色,故D错误.
故选C.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握物质的性质以及转化关系的判断,把握反应的现象,本题的突破口为q、s,注意把握物质的性质以及元素周期率,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 |
| B | 用黄铜片在铜片上刻画 | 铜片上有划痕 | 铜的硬度比黄铜小 |
| C | 用洁净的铁丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 溶液中一定含有Na+,可能含有K+ |
| D | 向硅酸钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比硅酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验 II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素A、C电负性大小关系为A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
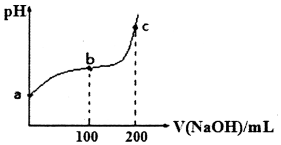
| A. | b~c段,随着NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 | |
| B. | 若a点pH=4,且c(Cl-)=100c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{101}$ | |
| C. | b点对应的溶液可用pH试纸测定其pH | |
| D. | c点对应的溶液中:c(Na+)>c(OH-)>c(C1-)>c(C1O-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
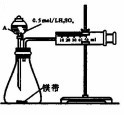 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| C. |  能发生加成反应和取代反应 能发生加成反应和取代反应 | |
| D. | 合成纤维与光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN溶液加水稀释,电离度保持不变,$\frac{c({F}^{-})}{c(HF)}$增大 | |
| B. | 向氨水中加入NH4Cl固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大 | |
| C. | NH4HCO3溶液呈碱性,由此可知Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | AgCl在饱和NaCl溶液中的溶解度及Ksp都比在纯水中的小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com