
分析 电解质:在水溶液中或熔融状态下能够导电的化合物;能导电的物质中含有自由移动的离子或是电子.
解答 解:①液态HCl不导电,在水溶液状态下导电,属于电解质;
②酒精不能导电,在水溶液中也不能电离出自由移动的离子,是非电解质;
③CO2不能导电,在水溶液中也不是自身电离导电,是非电解质;
④稀H2SO4溶液能导电,是混合物,不是电解质;
⑤CaO固体不能导电,在熔融状态下自身电离导电,是电解质;
⑥NaCl溶液能导电,是混合物,不是电解质;
⑥H2SO4 不能导电,在水溶液中能导电,是电解质;
能导电的是④⑥;属于电解质的有①⑤.
故答案为:④⑥;①⑤.
点评 本题考查物质的导电性的判断,电解质概念的辨析,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件.


科目:高中化学 来源: 题型:选择题
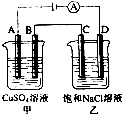 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )| A. | 甲烧杯中B极上最多可析出铜0.64g | |
| B. | 甲烧杯中A极上电极反应式4OH--4 e-═2H2O+O2↑ | |
| C. | 烧杯中D极上电极反应式为4H++4 e-═2H2↑ | |
| D. | 乙烧杯中滴入酚酞试液,C极附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.
某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在30 mL 1 mol/L Na2SO3溶液中通入标准状况下的Cl2 224 mL:H2O+SO${\;}_{3}^{2-}$+Cl2═SO${\;}_{4}^{2-}$+2Cl-+2H+ | |
| B. | 硝酸银溶液中滴加过量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| D. | 碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++HCO3- | B. | H2SO4=2H++SO42- | ||
| C. | Na2S=Na22++S2- | D. | NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com