
【题目】卤块的主要成分是MgCl2,还含有少量SiO2。现以卤块为原料按如图所示流程进行生产,用于制备金属镁。

请回答下列问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施是____________(任写一条)。
(2)步骤②得到的X是___(填化学式),能够分离得到沉淀的方法是_____
(3)写出步骤④的化学方程式:_______
(4)步骤①中溶解卤块的盐酸如果过量太多造成的影响是____
【答案】加热(将卤块粉碎或不断搅拌等) SiO2 过滤 MgCl2![]() Mg +Cl2↑ 盐酸过多步骤③中消耗更多的氢氧化钠
Mg +Cl2↑ 盐酸过多步骤③中消耗更多的氢氧化钠
【解析】
由流程图可知,向卤块中加入过量盐酸,MgCl2溶于盐酸,SiO2不溶,过滤得到氯化镁和盐酸的混合溶液和二氧化硅固体,则X为二氧化硅;向氯化镁和盐酸的混合溶液中加入氢氧化钠溶液,中和盐酸,与氯化镁反应生成氢氧化镁沉淀;氢氧化镁沉淀溶于盐酸得到氯化镁溶液,氯化镁溶液经蒸发浓缩、冷却结晶、过滤得到氯化镁晶体,氯化镁晶体脱去结晶水得到无水氯化镁,电解熔融氯化镁制得金属镁。
(1)步骤①中,适当增加稀盐酸的浓度,加热升高温度,将卤块粉碎增加固体表面积,不断搅拌和振荡均可加快酸溶速率,故答案为:加热(将卤块粉碎或不断搅拌等);
(2)由流程图可知,向卤块中加入过量盐酸,MgCl2溶于盐酸,SiO2不溶,过滤得到氯化镁和盐酸的混合溶液和二氧化硅固体,则X为二氧化硅,故答案为:SiO2;过滤;
(3)步骤④为电解熔融氯化镁制得金属镁,反应的化学方程式为MgCl2![]() Mg +Cl2↑,故答案为:MgCl2
Mg +Cl2↑,故答案为:MgCl2![]() Mg +Cl2↑;
Mg +Cl2↑;
(4)步骤①中溶解卤块的盐酸如果过量太多,步骤③得到氢氧化镁沉淀时,中和盐酸消耗氢氧化钠溶液的量会增大,故答案为:盐酸过多步骤③中消耗更多的氢氧化钠。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的1/2,下列说法正确的是
A. 简单离子半径M>W>Z>X
B. M2W2与足量的CO2完全反应,转移2mol电子时增重28g
C. X、Z两种元素只能组成化学式为ZX3的化合物
D. 由X、Y、Z、W四种元素形成的化合物既有共价化合物也有离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种粒子的结构示意图中,说法正确的是
① ②
② ③
③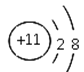 ④
④
A. 它们表示四种不同的元素B. ①④表示的是阳离子
C. ①③④表示的元素都是非金属元素D. ②表示的元素在化合物中通常显+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
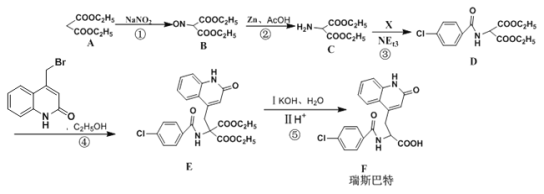
已知:Y的结构简式为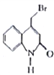 。
。
(1)A的化学名称为___________,化合物F的分子式为___________。
(2)化合物C中官能团的名称为___________,C与足量的NaOH溶液反应的化学方程式为___________。
(3)反应①~④中,属于取代反应的是___________(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为___________。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:___________
I.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
I1.苯环上有两个取代基,且处于对位;
Ⅲ.能与 NaHCO3溶液发生反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_______(填“能”或“不能”), 其原因是____________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量________________(填“相等”“不相等”),若实验操作均正确,则所求中和热_________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国C.Marchetin博士对世界一次能源替代趋势作了如图所示预测。回答下列问题:

(1)图中属于化石能源的有煤、石油和_____。
(2)目前采用铀核裂变方式获取核能,![]() 中含有的中子数为____;
中含有的中子数为____;![]() 与
与![]() 的关系是_____。
的关系是_____。
(3)太阳能是一种新能源,制造太阳能电池的材料有Si、Ga、As等。它们能用于制造太阳能电池是利用其____性质;Ga与As均是第四周期的主族元素,Ga与Al同主族,As与N同主族,则元素As、Ga的最高价氧化物对应水化物酸性较强的是____(填化学式)。
(4)近年来我国在南海成功试开采可燃冰,可燃冰释放的气体主要有CH4、少量乙烷、丙烷及丁烷等。丙烷完全燃烧的化学方程式为____;异丁烷的一氯取代物有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是

A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为CH3OH+H2O6e===CO2+6H+
D. 电池的正极反应式为O2+2H2O+4e===4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
D. W、X、Q三种元素都能形成多种氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com