
| A. | 第二周期ⅣA族 | B. | 第三周期ⅣA族 | C. | 第四周期ⅣA族 | D. | 第二周期ⅥA族 |
分析 根据元素的原子核外电子排布规律:第一层排满了只能排2个电子,第二层排满了只能排8个电子,最外层不能超过8个电子,X元素的原子,其次外层电子数是最外层电子数的一半,即最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,周期数=电子层数,族数=最外层电子数,据此分析解答.
解答 解:原子核外电子的排列规律为:第一层排满了只能排2个电子,第二层排满了只能排8个电子,最外层不能超过8个电子,
某元素X,它的原子次外层电子数是最外层电子数的一半,该元素的原子最外层电子数是次外层电子数的两倍,所以该元素核外电子只能有两层,所以第一层是2,第二层是4,所以质子数是6,所以是碳元素,周期数=电子层数,族数=最外层电子数,所以处在第二周期ⅣA族,
故选A.
点评 本题考查了原子结构与元素周期表的关系,题目难度不大,明确原子核外电子排布规律为解答关键,注意掌握元素周期表结构,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
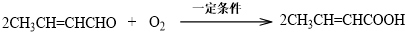 .
.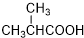 .
. 为起始原料(其他原料任选),制备
为起始原料(其他原料任选),制备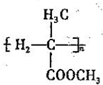 的合成路线:
的合成路线: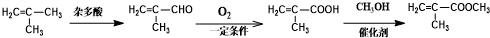
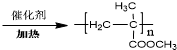 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
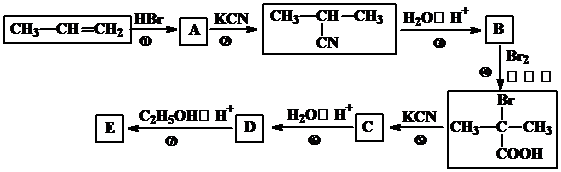
 .
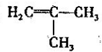
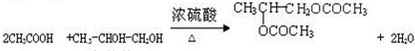
.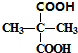 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.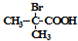 与足量NaOH乙醇溶液反应的化学方程式为
与足量NaOH乙醇溶液反应的化学方程式为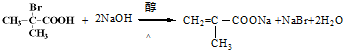 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
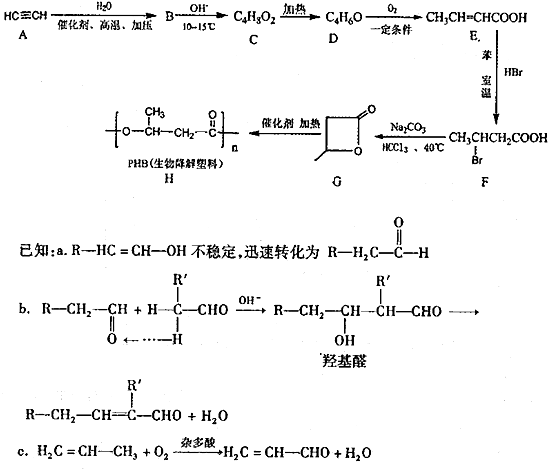
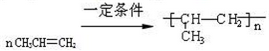
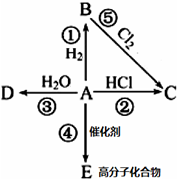 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: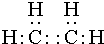 ,其中所含化学键的类型为共价键,E的结构简式为
,其中所含化学键的类型为共价键,E的结构简式为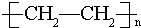 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 13mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
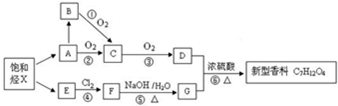
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com