
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强
B. 原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高
D. 同周期元素中Y的最高价含氧酸的酸性最强
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
X、Y、Z、W四种短周期元素,若:①X的阳离子与Y的阴离子具有相同的电子层结构,②W的阳离子的氧化性强于同主族带等电荷数的X的阳离子的氧化性,③Z的阴离子半径大于同主族带等电荷数的Y的阴离子半径,则这四种元素的原子序数由大到小的顺序为( )
A. W>Y>X>Z B. Z>Y>W>X C. X>Y>Z>W D. Z>X>Y>W
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:简答题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:
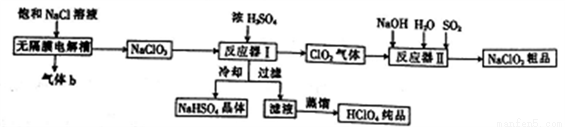
已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中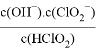 =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:选择题
下列项目判断,结论正确的是
选项 | 项目 | 结论 |
A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:简答题
化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:
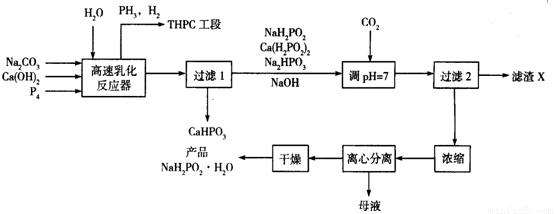
回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:推断题
某研究小组以对氨基水杨酸和乙炔为主要原料,按下列路线合成便秘治疗药物——琥珀酸普卡必利。
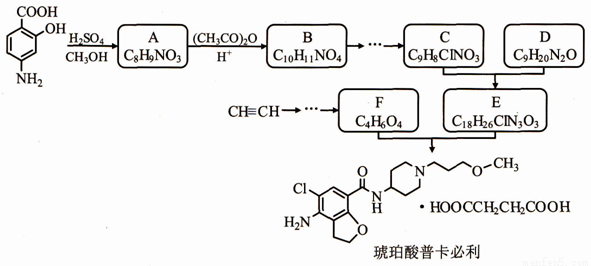
已知:①化合物B中含有羟基;
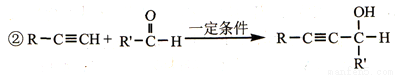
请回答:
(1)下列说法不正确的是_________
A.对氨基水杨酸能发生缩聚反应生成高分子化合物
B.化合物B能发生氧化反应,不能发生还原反应
C.化合物C能形成内盐
D.化合物F能与NaHCO3溶液反应
(2)化合物B的结构简式是_________。
(3)C+D→E的化学方程式是____________。
(4)写出同时符合下列条件的A 的所有同分异构体的结构简式_________。
①分子中含有硝基且直接连在苯环上
②1H-NMR谱显示苯环上有两种示同花学环境的氢原子
③不能与FeCl3溶液发生显色反应
(5)设计以乙炔和甲醛为原料制备化合物F的合成路线(用流程图表示,无机试剂任选)_________________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
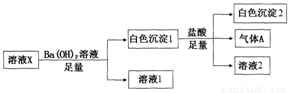
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 二氧化硫和氯气都能使品红溶液褪色
B. 漂白粉暴露在空气中久置会变质
C. 在加热条件下,镁能在二氧化碳气体中燃烧
D. 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一下学期第一次联考(3月)化学试卷(解析版) 题型:实验题
某同学在实验室研究Fe与H2SO4的反应
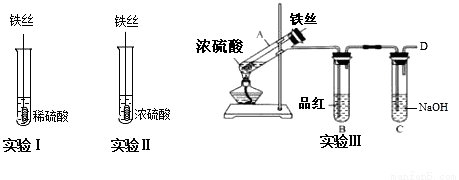
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为__.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是__,装置C的作用是__.
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有_________,
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是(____)
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于________.
②影响反应产物多样性的因素有_____________________(至少填两个).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com