
科目:高中化学 来源: 题型:选择题
| A. | c(H2SO3)>c(SO32-) | |
| B. | 溶液中HSO3-电离程度大于水解程度 | |
| C. | 水电离出c(H+)=10-5mol•L-1 | |
| D. | c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | agC2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 2.24L12C18O或14N2所含的电子数为1.4NA | |
| C. | 1L0.1mol/L的CuSO4溶液中含有Cu2+的数目为0.1NA | |
| D. | 25℃时,在PH=12的1.0LBa(OH)2溶液中含有OH-的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑦ | B. | 除外②都是 | C. | ①④⑥⑦ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 | |
| B. | 浓硫酸具有吸水性,说明可用浓硫酸干燥氨气 | |
| C. | 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+ | |
| D. | 常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
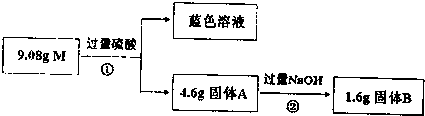
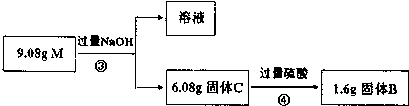
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com