
| A. | 物质的溶解过程,实质上就是其电离过程 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 1L0.1 mol•L-1的H2SO4溶液中含有0.2 molH+ | |
| D. | 1L0.1 mol•L-1的H2SO3溶液中含有0.2 molH+ |
分析 A.溶解过程是物质分子或离子分散到溶剂中去;电离是将分子或离子拆分成阴阳离子;
B.二氧化硫水溶液能导电,但电离出阴阳离子的物质不是二氧化硫;
C.硫酸是强电解质,在水溶液中完全电离;
D.亚硫酸是弱电解质,在水溶液中部分电离.
解答 解:A.溶解过程是物质分子或离子分布到溶剂中去;电离是将分子或离子拆分开来,比如说I2的溶解,不能说是电离,但电解质的溶解过程为其电离过程,故A错误;
B.二氧化硫水溶液能导电,但电离出阴阳离子的物质不是二氧化硫,而使亚硫酸,所以该溶液中亚硫酸是电解质、二氧化硫是非电解质,故B错误;
C.硫酸是强电解质,在水溶液中完全电离,所以1L0.1 mol•L-1的H2SO4溶液中含有0.2 molH+,故C正确;
D.亚硫酸是弱电解质,在水溶液中部分电离,所以1L0.1 mol•L-1的H2SO3溶液中含有H+小于0.2 mol,故D错误;
故选C.
点评 本题考查弱电解质的电离、电解质和非电解质判断、物质的溶解和电离关系等知识点,侧重考查学生分析比较判断能力,明确基本概念及强弱电解质电离特点是解本题关键,易错选项是B,题目难度不大.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 盐类都可用作调味品 | |
| C. | 铝罐可久盛食醋 | |
| D. | 生石灰用作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
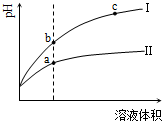
| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度小于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性Na>Mg>Al | B. | 氧化性Cl2>S>P | ||
| C. | 酸性H2SO4>H3PO4>HClO4 | D. | 稳定性HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 mol NH3分子 | B. | 含NH3和NH4+之和为1mol | ||
| C. | 含NH3、NH4+、NH3•H2O之和为1 mol | D. | 含NH3•H2O 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 Y、Z、M 三种元素形成的化合物可以既有离子键,又有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com