
| ||
| t/s | 0 | 500 | 1 000 |
| c(H2)/(mol?L-1) | 5.00 | 3.52 | 2.48 |
| c (CO)/(mol?L-1) | 2.50 | |
| △c |
| △t |
| △c |
| △t |
| 3.52 |
| 2 |
| 2.48 |
| 2 |
| (5.00-3.52)mol/L |
| 500s |
| (5.00-2.48)mol/L |
| 1000s |
| 1 |
| 2 |
| 2.52mol/L |
| 5.00mol/L |
| 1 |
| 2 |


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
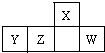 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.224L |
| B、0.672L |
| C、0.112L |
| D、0.336L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.21 mol |
| B、0.25 mol |
| C、0.3 mol |
| D、0.35 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸除去暖瓶中的水垢:2H++CaCO3═Ca2++CO2↑+H2O |
| B、利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- |
| C、氢氧燃料电池在酸性介质中的正极反应:O2+4e-+2H2O=4OH- |
| D、汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、Ca(OH)2、NH3?H2O |
| B、NH4Cl、CH3COOH、Na2S |
| C、HBr、HCl、BaSO4 |
| D、HClO、NaF、Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com