

| A.简单离子半径:Y>X |
| B.最高价氧化物对应水化物的酸性:Z>Y |
| C.W与X形成的化合物属于离子化合物 |
| D.W、X、Z只能形成一种化合物 |
科目:高中化学 来源:不详 题型:单选题
| A.第一电离能越小的元素其单质金属活泼性一定越大 |
| B.电负性越小的元素金属性一定越强 |
| C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键 |
| D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
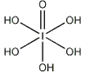 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
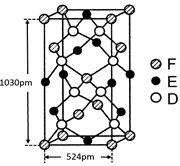
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | ——- | -3 | -2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
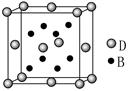
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X2-的还原性一定大于Y- |
| B.由mXa+与nYb-得m+a = n-b |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com