
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
【答案】MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O Br2+2I-===2Br-+I2 KCl AgBr I2<Br2<Cl2<MnO2
Mn2++Cl2↑+2H2O Br2+2I-===2Br-+I2 KCl AgBr I2<Br2<Cl2<MnO2
【解析】
H中加入淀粉溶液变蓝,说明H为I2单质,F溶液为橙色,应为溴水,即F是Br2单质,其通过反应②即加入G(钾盐)溶液后有单质I2生成,说明G溶液一定是KI溶液,则D为KBr,因为C+KBr→Br2+E,很容易联想到卤素间的置换反应,比Br2单质氧化性强的应是Cl2,所以C应该是Cl2,B为黑色粉末,可想到A和B的反应是制Cl2的反应,则A为HCl,E为KCl,I为AgBr。
(1)反应①是实验室制氯气反应,离子方程式为:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O,反应②是Br2与I-的置换反应,反应的方程式为:Br2+2I-===2Br-+I2,故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,反应②是Br2与I-的置换反应,反应的方程式为:Br2+2I-===2Br-+I2,故答案为:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O;Br2+2I-===2Br-+I2
Mn2++Cl2↑+2H2O;Br2+2I-===2Br-+I2
(2)C为Cl2,Cl2与KBr反应生成Br2和KCl,所以E为KCl,D为KBr与AgNO3反应生成AgBr沉淀,所以I为AgBr,故答案为:KCl;AgBr。
(3)B、C、F、H分别为:MnO2、Cl2、Br2、I2,根据氧化剂的氧化性大于氧化产物的氧化性,可以推出氧化能力由弱到强的顺序为I2<Br2<Cl2<MnO2,故答案为:I2<Br2<Cl2<MnO2


科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归纳的说法中,正确的数目有( )
①化学反应中一定有物质变化但不一定有能量变化
②CaO+H2O=Ca(OH)2是放热反应,说明CaO的能量高于Ca(OH)2的能量
③分解反应都是吸热反应
④H2→2H的过程需要吸收能量
⑤H、D、T互称为同素异形体
⑥ 和
和 互为同分异构体
互为同分异构体
⑦ ![]() 和
和![]() 是同一种物质
是同一种物质
⑧MgCl2的形成过程是![]()
⑨分子式为C4H10的烃的一氯代物的同分异构体有4种
⑩PCl5分子中,所有原子都满足最外层为8电子结构
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为___________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
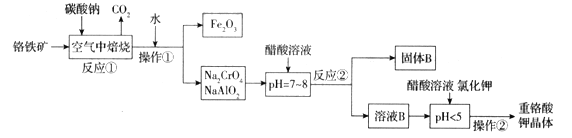
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有____________________________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 ( g / 100 g H2O ) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对环境有极大危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3] = 4.0×10-38,KspCr(OH)3] = 6.0×10-31)。已知电解后的溶液中c(Cr3+)为3.0×10-5mol/L,则溶液中c(Fe3+)为________________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
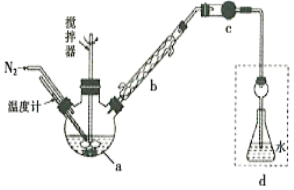
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:

回答下列问题:
(1)仪器a的名称是________,搅拌器的作用是_______。
(2)反应结束后,还要继续通入N2的目的是__________;仪器c盛装的试剂是________(填序号)。
A.碱石灰 B.浓硫酸 C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯:_____________
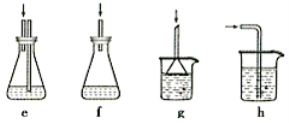
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_________(填序号)。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉放入硝酸铜、硝酸银的混合液中,反应停止后,产生少量不溶物,过滤后,取少量滤液滴加稀盐酸,无明显现象,则不溶物内一定含有( )
A.银、铜
B.铁、铜、银
C.铜
D.银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

按下列要求写出:
(1)聚乙烯的结构简式是_____________,乙醛的结构简式是_____________;
(2)反应①的化学方程式是________________________________,反应类型是___________;
(3)反应③的化学方程式是________________________________,反应类型是___________;
(4)反应⑤的化学方程式是________________________________,反应类型是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com