
| A. | 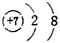 | B. | 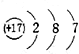 | C. | 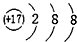 | D. | 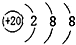 |
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 | |
| D. | 某有机物的结构简式为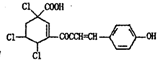 ,1mol该有机物通过消去反应脱去1 molHCl时,能得到5种不间产物(不考虑立体异构) ,1mol该有机物通过消去反应脱去1 molHCl时,能得到5种不间产物(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | X | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 27.5% | C. | 30% | D. | 37.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 单质与同浓度稀盐酸反应的速率为L<M | |
| B. | R与T形成的化合物一定能使品红溶液褪色 | |
| C. | 氢化物的稳定性为:H2T>H2R | |
| D. | 当单质L着火时,可用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
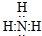 ;过氧化钠
;过氧化钠 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高反应体系的温度,可使反应速率变大 | |
| B. | 该反应中N2不可能100%转化为NH3 | |
| C. | 该反应达到平衡状态时,N2、H2和NH3三者的浓度一定相等 | |
| D. | 为了提高H2的转化率,可适当提高N2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
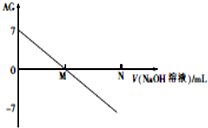 为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )
为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )| A. | 室温下,醋酸的电离平衡常数约为10-6 | |
| B. | M点加入NaOH溶液的体积大于20.00mL | |
| C. | M点时溶液中:c(CH3COO-)=c(Na+) | |
| D. | 若N点时加入NaOH溶液的体积为40mL,则N点时溶液中:c(Na+)=2[c(CH3COO-)+c(CH3COOH)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com