
| 压强(atm) | 4 | 6 | 10 | 20 |
| D的浓度(mol?L-1) | 0.085 | 0.126 | 0.200 | 0.440 |
| 生成物浓度的幂次方 |
| 反应物浓度幂次方 |
| 生成物浓度的幂次方 |
| 反应物浓度幂次方 |
| [D]d |
| [A]a |
| [D]d |
| [A]a |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 现象 |
| a.取少量粉末,加水,振荡 | 全部溶解,溶液无色透明 |
| b.向所得溶液中慢慢滴入氢氧化钠溶液并加热 | 无明确现象 |
| c.取少量粉末,加盐酸 | 粉末溶解,无其它明显现象 |
| d.取少量粉末,加稀H2SO4和稀硝酸混合液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
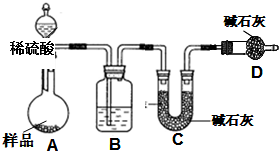
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 干燥氯气 |
B、 检验气体是否易溶于水 |
C、 制取并收集氨气 |
D、 配制50mL 0.10mol?L-1 KI溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com