
| A.工业生产硫酸时,使用热交换器可以充分利用反应热 |
| B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 |
| C.电镀精炼铜时,纯铜与直流电源的负极相连 |
| D.工业上金属Mg、Al都是用电解熔融的氯化物制得的 |
科目:高中化学 来源:不详 题型:实验题
 Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下: Na2CO3固体
Na2CO3固体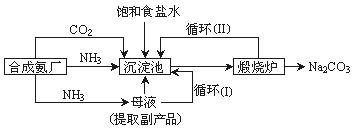
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
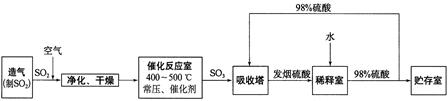
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
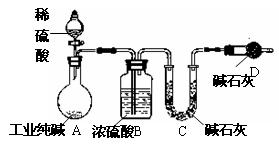
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
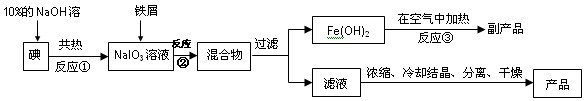
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
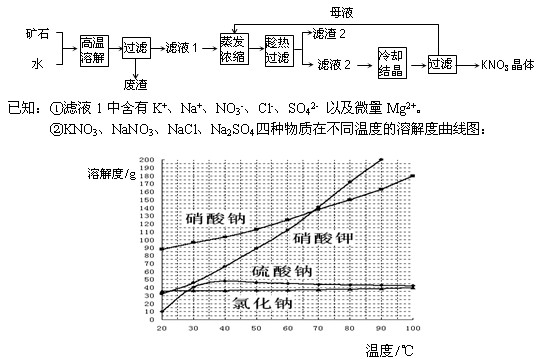
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 是一种重要的化工原料,工业上生产硝酸的主要过程如下:
是一种重要的化工原料,工业上生产硝酸的主要过程如下: 2NH3(g) △H<0
2NH3(g) △H<0 ,则N2的转化率a1= ;
,则N2的转化率a1= ; 2NO2(g)△H>0
2NO2(g)△H>0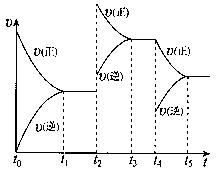
 2将NO2还原为N2。
2将NO2还原为N2。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ΔH<0;2SO2(g)+O2(g)
2NH3(g) ΔH<0;2SO2(g)+O2(g) 2SO3(g) ΔH<0;
2SO3(g) ΔH<0;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业中,N2和H2的最佳配比应为物质的量之比1:3 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.工业上电解饱和食盐水制烧碱,用离子交换膜阻止0H-移向阳极 |
| D.在镀件上电镀锌,锌作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com