
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为 ;
(2)用离子方程式表示G 的非金属性比F强 ;
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为 ,X与水反应的产物名称是
;
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则燃烧1mol B2A2放出的热量为 KJ;


(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位mol·L-1)。要使c(E2+) 为0.001 mol·L-1的溶液形成沉淀,则溶液的PH值至少升高到 。
【知识点】位置、结构、性质间关系,元素周期律
【答案解析】 (1) (2分) (2)Cl2+H2S=S↓+2HCl (2分)
(2分) (2)Cl2+H2S=S↓+2HCl (2分)
(3)MgS+2O2 MgSO4 (2分) (4)NCl3 (2分) 次氯酸和氨气 (2分)
MgSO4 (2分) (4)NCl3 (2分) 次氯酸和氨气 (2分)
(5)8Q KJ (2分) (6) 8 (2分)
解析:A、B元素的最高正价与最低负价的代数和均为零,则A是氢元素,B是碳元素;C元素是植物生长三大营养元素之一,原子序数大于硅,则C是氮元素;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体,D是氟元素;E原子核外K层电子数与M层电子数相等,为镁元素;F原子的价电子数等于电子层数的两倍,则F为硫元素,G为氯元素;(1)CD3 是NF3,其电子式为 ; (2)用离子方程式表示Cl 的非金属性比S强:Cl2+H2S=S↓+2HCl;(3)MgF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为:MgS+2O2
; (2)用离子方程式表示Cl 的非金属性比S强:Cl2+H2S=S↓+2HCl;(3)MgF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为:MgS+2O2 MgSO4 ,(4)N的氢化物(NH3)与Cl的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,(应该是HCl),方程式为:NH3+3Cl2=NCl3+3HCl ,则X的化学是为NCl3;X与水反应:
MgSO4 ,(4)N的氢化物(NH3)与Cl的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,(应该是HCl),方程式为:NH3+3Cl2=NCl3+3HCl ,则X的化学是为NCl3;X与水反应:
NCl3 + 3H2O ==NH3 + 3HClO ;产物名称是:次氯酸和氨;(5)充分燃烧一定量的C2H2放出Q kJ的能量,燃烧生成的产物CO2恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则CO2的物质的量为0.25mol ,燃烧1mol C2H2生成CO2 2mol,放出的热量为8Q;
(6)根据Mg(OH)2在水中的沉淀溶解平衡曲线得出Ksp=C(Mg2+)·C2(OH-)=10-5×(10-5)2=10-15;要使c(Mg2+) 为0.001 mol·L-1的溶液形成沉淀,带入Ksp,C(OH-)=10-6mol/L,PH=8;
【思路点拨】本题考查结构性质位置关系、电子式、热化学方程式、难溶沉淀溶解平衡,难度中等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,一个密闭容器中;加入1molN2和3moH2发生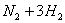

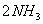 反应,则下列叙述正确的是( )
反应,则下列叙述正确的是( )
A.若速率V(N2): V(H2) : V(NH3) = 1:3:2 ,则该反应反应达到了 平衡状态
B. 反应开始时,若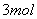
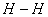 键断裂,则有2mol N—H 键生成
键断裂,则有2mol N—H 键生成
C. 改变条件可以改变该反应限度,会使反应物完全反应
D. 当反应混合物各组分的物质的量浓度不再改变,该反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
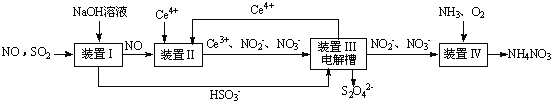
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
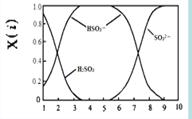
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
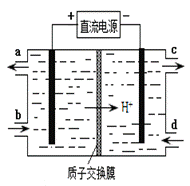
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
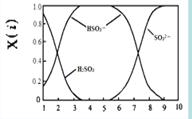
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(6)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
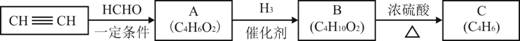
已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。
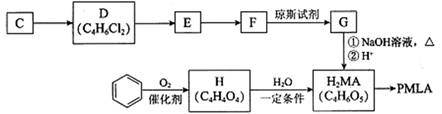
已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于烃的性质的说法中正确的是( )
A.苯和甲苯都能与硝酸发生苯环上的取代反应
B.苯和甲苯使酸性高锰酸钾溶液褪色
C.苯和己炔都能使溴的四氯化碳溶液褪色
D.苯和乙烷与卤素单质发生取代反应都需要铁作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
3.2 g铜与过量HNO3(8 mol·L-1,30 mL)充分反应,HNO3的还原产物为NO2和NO,反应后溶液中所含H+为a mol,则此时溶液中所含的NO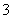 为( )
为( )
A.a mol B.(0.24-a)mol
C.(0.1+a)mol D.(0.14+a)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com