
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lNA
B. 在0.1 mol·L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1NA![]()
C. 标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D. 50mL l2mol·L的浓盐酸与足量MnO2反应,转移电子总数为0.3NA
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为 .
(2)①CH2=CH2、②CH≡CH、③ ![]() 、④CH3﹣CH3这四种分子中碳原子采取sp2杂化的是(填序号).
、④CH3﹣CH3这四种分子中碳原子采取sp2杂化的是(填序号).
(3)如图为某晶体的一个晶胞示意图,该晶体由A、B、C三种基本粒子组成,则该晶体的化学式为 . 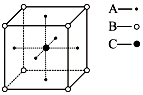
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为01mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg![]() 随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
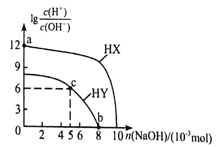
A. a点溶液的ph=2
B. 水的电离程度:a<b<c
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. c点溶液中:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一.
(1)化学反应中有能量变化的本质原因是反应过程中有的断裂和形成.
(2)已知拆开1molH﹣H键、1molCl﹣Cl键、1molH﹣Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应 H2(g)+Cl2(g)=2HCl (g)的△H= .
(3)已知:CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+
O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(4)已知25℃、101kPa下,稀的强酸与稀的强碱溶液反应的中和热为﹣57.3kJ/mol. ①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,若关闭活塞A,则品红溶液无变化,石蕊试液变红,石灰水变浑浊;若打开活塞A,则品红溶液褪色,石蕊试液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是
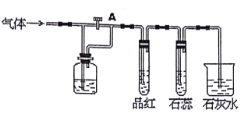
A. C12和NaHSO3溶液 B. HCl和浓H2SO4
C. C12和氯水 D. SO2和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝([Al2( OH)nCl6-n]m}是一种新型高效净水剂,与一般絮凝剂相比,它的吸附能力强、絮凝率高,可由AlCl3经水解法制得。回答下列问题:
(1)工业上可用Cl2、Al2O3和焦炭在高温下反应制取AlCl3![]()
已知:4Al(s)+3O2(g)=2Al2O3(s) △H1
2C(s)+O2(g)=2CO(g) △H2
2Al(s)+3Cl2(g)=2A1Cl3(g) △H3
①Al2O3(s)+3C(s)+3Cl2(g) ![]() 2AlCl3(g)+3CO(g) △H=____________________。
2AlCl3(g)+3CO(g) △H=____________________。
②反应3A12O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
(2)AlCl3在水溶液中分三步水解
Al3++H2O![]() Al(OH)2++H+ K1
Al(OH)2++H+ K1
Al(OH)2++H2O![]() Al(OH)2++H+ K2
Al(OH)2++H+ K2
Al(OH)2++ H2O![]() Al(OH)3+H+ K3
Al(OH)3+H+ K3
①K1、K2、K3由小到大的顺序是_______________________。
②控制溶液的pH在一定范围内,上述水解产物才能聚合生成聚合氯化铝。pH偏小时,Al3+的水解程度弱;pH偏大时的影响是___________________________。
(3)已知有如下可逆反应: ![]()
![]()
298K时,将1mL 1 mol·L-1 AlCl3溶液与1mL2 a mol ·L-1H2QSI溶液混合发生上述反应,溶液中c[Al(HQSI)2+]与时间(t)的关系如图所示。
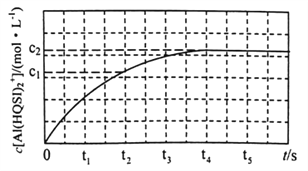
①下列可判断该反应达到平衡状态的是______________(填标号)。![]()
A.溶液的pH不再变化 B. v(Al3+)=v [Al(HQSI)2+]
C.溶液颜色不再变化 D.c(A13+)/c(H2QSI)不再变化
②0~t2时间内,该反应的平均反应速率v(H2QSI)= _________________。
③298K时,该反应的平衡常数K=_________________。
(4)该方法制得的聚合氯化铝的优点是不含其它金属离子,但盐基度低(盐基度:衡量絮凝剂絮凝效果的重要指标,定义式为:盐基度=n(OH)/3n(Al),n为物质的量)。常温下实验测量样品的盐基度,取m g样品,该样品中Al的质量分数为w;加入煮沸后冷却的蒸馏水溶解,配成1L溶液,测得该溶液pH=9.0。则其盐基度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子结构及其性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸[CH3CH(OH)COOH]属于手性分子,因分子中存在手性碳原子
C.配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道
D.酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.H+、Fe2+、ClO﹣、Na+
B.Na+、H+、SO42﹣、CO32﹣
C.Fe3+、Cl﹣、Br﹣、SCN﹣
D.Al3+、NO3﹣、H+、NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com