
| A. | 35Cl-和37Cl-离子结构示意图均可以表示为: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: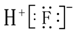 | |
| D. | 质子数为92、中子数为146的U原子:14692U |
分析 A.Cl-离子的质子数为17,核外电子数为18;
B.HClO的电子式为 ;
;
C.HF为共价化合物,只含共价键;
D.质子数为92、中子数为146的U原子,其质量数为92+146=238.
解答 解:A.Cl-离子的质子数为17,核外电子数为18,则35Cl-和37Cl-离子结构示意图均可以表示为 ,故A正确;
,故A正确;
B.HClO的电子式为 ,结构式为H-O-Cl,故B错误;
,结构式为H-O-Cl,故B错误;
C.HF为共价化合物,只含共价键,HF的电子式为 ,故C错误;
,故C错误;
D.质子数为92、中子数为146的U原子,其质量数为92+146=238,则U原子为23892U,故D错误;
故选A.
点评 本题考查化学用语,为高频考点,把握电子式、结构示意图、结构简式为解答的关键,侧重分析与应用能力的考查,注意化学用语的区别及规范使用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,含有相同分子数的两种气体,占有相同的体积 | |
| B. | 同温同压下,相同物质的量的两种任何气体,含有相同的分子数 | |
| C. | 同温同压下,相同体积的两种气体,物质的量相同 | |
| D. | 同温同压下,2升O2与2升由CO2和CO组成的混合气体含有相同的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
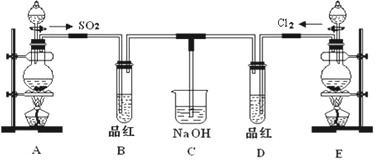
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为8的碳原子:${\;}_{6}^{8}$C | B. | 氯化钙的电子式: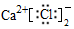 | ||
| C. | S2-的结构示意图: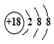 | D. | 2-溴丙烷的结构简式:(CH3)2CHBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56L | B. | 1.68L | C. | 2.24L | D. | 1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残余固体可能为铁和铜的混合物 | |
| B. | 最后得到的溶液可能含有Fe3+ | |
| C. | 残余固体是铁,溶液中一定不含Cu2+ | |
| D. | 残余固体一定全部是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有⑤ | B. | 均能 | C. | ③④⑤ | D. | 均不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| D. | KClO3溶液与浓盐酸反应:ClO3-+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com