
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验I 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
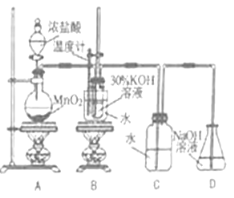
(1)盛放浓盐酸的实验仪器名称是 。
(2)A中发生反应的化学方程式是 。
(3)B中生成氯酸钾的离子反应方程式是 。
(4)若对调B和C装置的位置, (填“能”或“不能”)提高B中氯酸钾的产率,原因是 。
实验II 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定。
乙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样。
a.量取试样20.00ml,用0.10mol·L―1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,则该次滴定所测的试样中盐酸浓度为 ;
b.重复滴定三次后获得实验结果。
②进行乙方案实验:装置如下图所示(夹持器具已略去)。
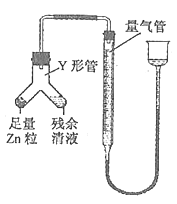
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中,否则会造成实验结果偏低。
(ii)反应完毕,读取H2的体积,读数时应注意:A.冷却至室温b. C.视线与凹液面最低处相切。
【答案】实验Ⅰ.(1)分液漏斗;(2)MnO2+4HCl(浓) ![]() MnCl2+ Cl2↑+2H2O;(3)3Cl2+6OH-
MnCl2+ Cl2↑+2H2O;(3)3Cl2+6OH- ![]() ClO3-+5Cl-+3H2O;(4)能;水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率; 实验Ⅱ.①0.12 mol·L—1;②(i)锌粒;残余清液;(ii)调整量气管与漏斗内液面相平。
ClO3-+5Cl-+3H2O;(4)能;水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率; 实验Ⅱ.①0.12 mol·L—1;②(i)锌粒;残余清液;(ii)调整量气管与漏斗内液面相平。
【解析】
试题分析:实验I.(1)盛放盐酸的仪器为分液漏斗;(2)A制备氯气,其反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+ Cl2↑+2H2O;(3)氯气和KOH的反应,其离子反应方程式为:3Cl2+6OH-
MnCl2+ Cl2↑+2H2O;(3)氯气和KOH的反应,其离子反应方程式为:3Cl2+6OH- ![]() ClO3-+5Cl-+3H2O;(4)水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率,故能调换;实验II.①H + + OH- = H2O,n(HCl) = n(NaOH) = 24×10-3×0.1mol,c(HCl) = 24×10-3×0.1/20×10-3mol·L-1 = 0.12mol·L-1;②(i)为使酸全部参加反应,根据装置图,应将锌粒转移到残余清液中;(ii)为了方便换算到标准状况下,需要调整量气管与漏斗内液面相平,使压强相等。
ClO3-+5Cl-+3H2O;(4)水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率,故能调换;实验II.①H + + OH- = H2O,n(HCl) = n(NaOH) = 24×10-3×0.1mol,c(HCl) = 24×10-3×0.1/20×10-3mol·L-1 = 0.12mol·L-1;②(i)为使酸全部参加反应,根据装置图,应将锌粒转移到残余清液中;(ii)为了方便换算到标准状况下,需要调整量气管与漏斗内液面相平,使压强相等。


科目:高中化学 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有 性。
(2)工业上可以通过下列方法制取ClO2,请完成该反应化学方程式:
2KClO3+ SO2 = 2ClO2 + 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2(g) + 3B2(g)==2C(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是
A. v(B2) =0.9mol/(Ls)
B. v(A2) =0.5mol/(Ls)
C. v(C) =0.62mol/(Ls)
D. v(B2) =90.0mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手。
I.研究发现,NOx是雾霾的主要成分之一,NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50kJ·mol-1
2NO(g) △H=+180.50kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-566.00 kJ·mol-1
2CO2(g) △H=-566.00 kJ·mol-1
为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环,写出该反应的热化学方程式 。
II.开发利用清洁能源可减少污染,解决雾霾问题。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景,一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。
CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。

(1)该反应的反应热△H 0(填“>”或“<”),压强的相对大小与P1 P2(填“>”或“<”)。
(2)该反应化学平衡常数表达式为 。
(3)下列各项中,不能说明该反应已经达到平衡的是 。
A.容器内气体压强不再变化
B.v(CO):v(H2):v(CH3OH)=1:2:1
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下,在保证H2浓度不变的情况下,增大容器的体积,平衡 (填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是 。
III.依据燃烧反应原理,合成的甲醇可以设计如图所示的燃料电池装置。

(1)负极电极反应式为 。
(2)电池工作时,若电流强度为I,1个电子所带电量为q,NA为阿伏伽德罗常数的值,则该装置每分钟消耗甲醇的物质的量为 mol(假设化学能全部转化为电能)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是
A.焰火的五彩缤纷是某些金属元素物理性质的展现
B.PM2.5是指大气中直径接近2.5×l0-6m的颗粒物,分散在空气中形成胶体
C.石英用于生产光导纤维和计算机芯片
D.食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z都是周期表中短周期元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,W、Y能组成两种离子化合物;
②Y和X属同周期元素,它们能形成两种常见的化合物;
③X和Z不在同一周期,它们能形成许多种化合物;
④W和X、Y、Z四种元素能形成一种水溶液显碱性的化合物;
(1)W元素是 ;
(2)Y和Z形成的两种常见化合物的分子式是 和 。
(3)写出W、X、Y、Z四种元素形成的化合物与盐酸反应的离子方程式
。
(4)写出X和Z形成的一种六元环状的具有芳香气味的液态化合物跟液溴在溴化铁作用下反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提高能源的利用率已成为国际能源研究的热点课题。下列相关措施使用不当的是( )
A.使燃料充分燃烧
B.加大能源开采力度
C.加强能源利用的科技投入
D.合理使用能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
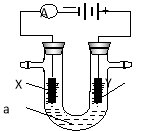
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极是电解池的 极,该电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯可用于制备高频绝缘材料,苯乙烯在一定条件下存在如下图转化关系。

请回答下列问题:
(1)由苯乙烯合成高聚物的化学方程式为 。
(2)写出F中官能团的名称:
(3)C可能的结构简式有 。
(4)H有多种同分异构体,请写出官能团不完全相同的两种同分异构体的结构简式:
。
(5)反应③的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com