
分析 (1)反应自发进行的判断依据是△H-T△S<0,反应前后气体体积减少熵变小于0,体积增大熵变大于0;
(2)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,正逆反应平衡常数互为倒数,化学方程式计量数变化,平衡常数随计量数变化.
解答 解:(1)①2H2O(l)=2H2(g)+O2(g),反应前后气体体积增大,△S>0,分解反应△H>0,当高温下满足△H-T△S<0,
故答案为:高温;>;>;
②NH3(g)+HCl(g)=NH4Cl(s),反应是化合反应为放热反应△H<0,反应前后气体体积减小,△S<0,当低温下满足△H-T△S<0,
故答案为:低温;<;<;
(2)①已知在448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数为49,2HI(g)?H2(g)+I2(g)上述反应的逆反应,反应的平衡常数K=$\frac{1}{49}$,
故答案为:$\frac{1}{49}$;
②已知在448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数为49,$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g) K=$\frac{c(HI)}{{c}^{\frac{1}{2}}({H}_{2}){c}^{\frac{1}{2}}({I}_{2})}$=$\sqrt{\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}}$=$\sqrt{49}$=7,
故答案为:7.
点评 本题考查了化学反应能量变化,反应自发进行的判断依据,平衡常数的书写和计算,注意平衡常数随温度变化,化学方程式书写计量数不同,平衡常数不同,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| B. | 某元素一种同位素原子的质子数为m,中子数为n.则这种元素的相对原子质量为m+n | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 仅由两种元素形成的共价化合物中可以同时含有极性共价键和非极性共价键强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第七周期第ⅦA族 | C. | 第八周期第ⅠA族 | D. | 第八周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
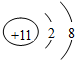 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的电子式:Cl:Cl | |
| B. | NH4Cl的电子式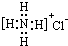 | |
| C. | 钠原子的结构示意图: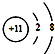 | |
| D. | 硫酸亚铁的电离方程式FeSO4═Fe2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol•L-1HNO2溶液的pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
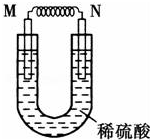 由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.
由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com