
【题目】Cu2O是一种用途广泛的无机化工原料,一种以氧化铜矿(CuO,含有Fe2O3、Al2O3、SiO2杂质)为原料制备Cu2O的流程如图所示:

已知氨浸过程中仅发生的反应为:CuO+4NH3·H2O= [Cu(NH3)4]2++2OH-+3H2O
回答下列问题:
(1)氨浸之前需将矿物粉碎、过筛,目的是_______________________________。
(2)氨浸时的温度一般不超过30℃,主要原因是__________________。按此工艺,能否用NaOH溶液代替氨水?__________________(填“能”或“否”)。
(3)蒸馏过程中会生成一种黑色固体,则此过程中发生反应的化学方程式为____________。
(4)电解过程中阳极的电极反应式为_________________。
(5)Cu(OH)2也可与NH3·H2O反应,已知常温下:
Cu(OH)2(s)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
[Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
Cu2+(aq)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
[Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
则常温下Ksp[Cu(OH)2]=________________。
(6)为了尽量减少流程中所用原料的种类,还原过程可用气体A代替气体B,在加热条件下生成两种单质,该反应的化学方程式为________________________。
【答案】选取细小颗粒,增大反应物接触面积,提高“氨浸”反应速率 温度过高会导致NH3·H2O分解,NH3逸出 否 [Cu(NH3)4](OH)2 ![]() CuO+4NH3↑+H2O 2Cu-2e-+2OH-=Cu2O+H2O 2.2×10-20 2NH3+3CuO
CuO+4NH3↑+H2O 2Cu-2e-+2OH-=Cu2O+H2O 2.2×10-20 2NH3+3CuO![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
【解析】
(1)固体参加反应,为扩大接触面积氨浸之前需将矿物粉碎、过筛;
(2)根据氨水易分解分析;
(3)含有Cu元素的化合物只有CuO,据此分析;
(4)Cu在阳极失去电子生成Cu2O,据此书写阳极电极反应式;
(5)根据Ksp[Cu(OH)2]的溶度积常数定义,结合与两个热化学方程式的关系计算;
(6)根据气体A是NH3,NH3气具有还原性,会发生氧化还原反应,据此分析。
(1)氧化铜矿氨浸之前需将矿物粉碎、过筛,目的是增大固体与氨水的接触面积,提高“氨浸”反应速率;根据Cu2+能否形成络离子分析;
(2)浸时的温度一般不超过30℃,主要原因是温度过高会导致NH3·H2O分解,NH3逸出。按此工艺,不能用NaOH溶液代替氨水,因为CuO与氨水发生反应生成铜氨络离子,而与NaOH不反应;
(3)蒸馏过程中会生成一种黑色固体,这是由于分解产生了CuO黑色固体,则此过程中发生反应的化学方程式为[Cu(NH3)4](OH)2 ![]() CuO+4NH3↑+H2O;
CuO+4NH3↑+H2O;
(4)Cu在阳极失去电子,产生的Cu2+与溶液中的OH-反应生成Cu2O,电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O;
(5) 常温下Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-),根据
Cu(OH)2(s)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
[Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
Cu2+(aq)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013,结合化学平衡常数的含义可得Ksp[Cu(OH)2]=
[Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013,结合化学平衡常数的含义可得Ksp[Cu(OH)2]=![]() =
=![]() =2.2×10-20;
=2.2×10-20;
(5)气体A是NH3,该气体具有还原性,可以将CuO还原为Cu,NH3被氧化为N2,同时反应产生水,反应方程式为:2NH3+3CuO![]() 3Cu+N2↑+3H2O。
3Cu+N2↑+3H2O。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3g3He含的中子数为2NA
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体所含碳原子数为2NA
C.标准状况下22.4LCl2与NaOH溶液完全反应,转移的电子数为2NA
D.1L0.4mol/L盐酸与0.1molMnO2共热后,生成Cl2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏伽德罗常数的值,则下列说法正确的是
A. 标准状况下,2.24L N2和O2的混合气体中分子数为0.1NA
B. 32g S8(分子结构: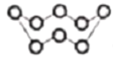 )中的共价键数目为8NA
)中的共价键数目为8NA
C. 3mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. pH=1的H3BO3溶液中,含有H+的总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法正确的是

A. 吸附层(a)上的电势比吸附层(b)上的高
B. 负极反应为H2+2e-+2OH-=2H2O
C. 该装置将酸碱中和反应的热能转化为电能
D. 电解质溶液中ClO4-由左往右迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用做酸、碱指示剂:HIn(aq) (红色溶液)![]() H+(aq)+In-(aq) (黄色溶液),在上述溶液中加入下列物质,最终能使指示剂显黄色的是
H+(aq)+In-(aq) (黄色溶液),在上述溶液中加入下列物质,最终能使指示剂显黄色的是
A. HCl B. Na2O2 C. Na2CO3溶液 D. NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转化为电能的装置。分析甲、乙两原电池装置,回答下列问题:

(1)甲、乙两装置中铜电极都产生大量的无色气泡,则Cr电极是______极,Cu电极表面发生反应的电极反应式为_______;与甲装置相比,乙装置的优点是________________,原因是_________。
(2)如果将甲装置中的稀硫酸改为浓硝酸,则铜电极上无气体产生,而铬电极上产生大量的有色气体。由(1)、(2)两个实验推测金属Cr具有的两点化学性质______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的表述正确的是
A. 当ΔH为“-”时,表示该反应为吸热反应
B. 已知C(s)+![]() O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C. 图丙表示催化剂能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com