
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据共价键的强弱规律,推出HF的沸点强于HCl | |
| D. | 根据无机含氧酸的强弱规律,推出HNO2的酸性强于H3PO3 |
分析 A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;
B.主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外;
C、根据分子间作用力的强弱规律;
D、含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.
解答 解:A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,所以Mg元素第一电离能大于Al元素,故A错误;
B.主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外,所以卤族元素中除了F元素外其它元素最高正化合价为+7,故B错误;
C、根据分子间作用力的强弱规律,氟化氢分子间存在氢键,所以HF的沸点强于HCl,故C错误;
D、含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,在HNO2中含有一个非羟基氧,而H3PO3中无非羟基氧,所以推出HNO2的酸性强于H3PO3,故D正确;
故选D.
点评 本题考查较综合,涉及第一电离能大小判断、元素化合价与族序数的关系、分子间作用力、酸性强弱等知识点,侧重考查学生对物质结构和元素周期律等基本理论的考查,题目难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
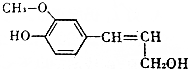 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )| A. | 该物质的分子式是C10H15O3,属于芳香族化合物 | |
| B. | 1mol该物质最多能与1molH2发生加成反应 | |
| C. | 1mol该物质只能与1molBr2反应 | |
| D. | 该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2CO+O2═2CO2是一个放热反应,则反应2CO2═2CO+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时需要吸收能量,实验氯化氢的总能量高于氢气和氯气的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol SO3的体积约为22.4L | |
| B. | 1 mol钠原子中含有的电子数为NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1molFe与足量的氯气反应时,转移的电子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
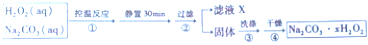
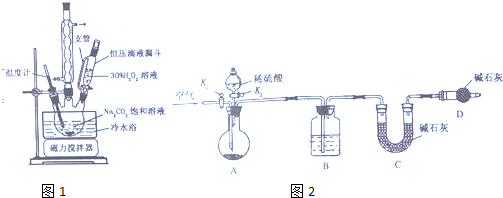
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用于呼吸面具中氧气的来源 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 乙醇可与金属钠反应放出氢气 | |
| D. | 金属钠着火时,可用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
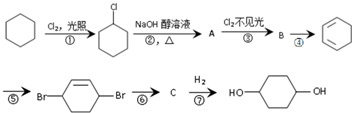
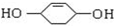 ;
;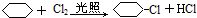
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com