
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol/L盐酸 | D. | 提高溶液的温度 |
分析 醋酸电离生成醋酸根离子和氢离子,要使溶液的pH增大,则溶液中氢离子浓度减小,据此分析解答.
解答 解:A、醋酸是弱电解质,加水稀释能促进水的电离,将溶液稀释到原体积的10倍,氢离子浓度大于原来的$\frac{1}{10}$,所以pH<(a+1),故A错误;
B、加入适量的醋酸钠固体,醋酸钠中含有醋酸根离子能抑制醋酸的电离,使溶液中氢离子浓度减小,所以能使溶液pH=(a+1),故B正确;
C、加入等体积的0.2 mol•L-1盐酸,氢离子浓度增大,溶液的pH值减小,故C错误;
D、提高温度促进醋酸的电离,使溶液中氢离子浓度增大,溶液的pH值减小,故D错误;
故选B.
点评 本题考查了弱电解质的电离,根据“加水稀释、提高温度都能促进醋酸的电离,加入含有相同离子的盐能抑制醋酸的电离”来分析解答,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| C. | 油脂水解的产物是氨基酸和甘油 | |
| D. | 淀粉和聚乙烯都是天然髙分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| B. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| C. | HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质 | |
| D. | H、D、T属于同位素,H2、D2、T2属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
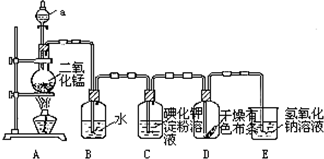
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
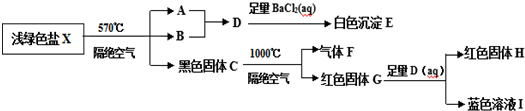
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
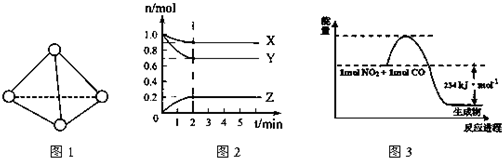
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com