
| A、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol/L |
| B、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D、pH相同的①CH3COONa、②NaHCO3两种溶液的c(Na+):①>② |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、明矾在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、江河入海口三角洲的形成通常与胶体的性质有关 |
| C、用激光笔检验淀粉溶液的丁达尔效应 |
| D、向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O和18O的物理性质和化学性质完全相同 |
| B、通过化学反应可以实现16O与18O的相互转化 |
| C、向2SO2(g)+O2(g)?2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 |
| D、用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
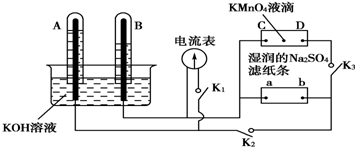
查看答案和解析>>
科目:高中化学 来源: 题型:
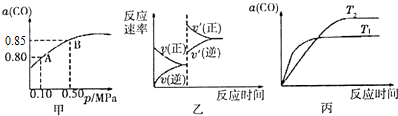
| A、由图甲知,A点CO的平衡浓度为0.4 mol?L-1 |
| B、由图甲知,B点CO、O2、CO2的平衡浓度之比为2:l:2 |
| C、达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D、若0.50 MPa时不同温度下CO转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
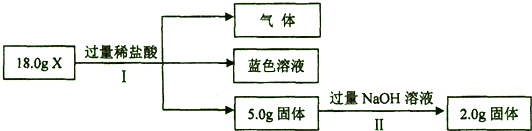
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com