
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)
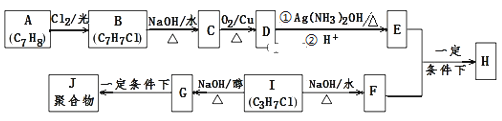
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
【答案】羧基 ![]() 取代反应(或水解反应) 加聚反应(或聚合反应)
取代反应(或水解反应) 加聚反应(或聚合反应) ![]() +CH3CH(OH)CH3
+CH3CH(OH)CH3![]()
![]() +H2O
+H2O ![]() +2Ag(NH3)OH
+2Ag(NH3)OH![]()
![]() +2Ag+3NH3+H2O 14
+2Ag+3NH3+H2O 14 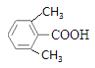 或
或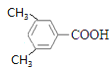
【解析】
A属于芳香烃,分子式为C7H8,则A为![]() ,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为
,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为![]() ,B发生水解反应生成C为
,B发生水解反应生成C为![]() ,C发生催化氧化生成D为
,C发生催化氧化生成D为![]() ,D与银氨溶液反应、酸化得到E为
,D与银氨溶液反应、酸化得到E为![]() .I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为
.I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为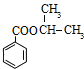 .I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为
.I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为![]() ,据此分析作答。
,据此分析作答。
(1)通过以上分析知,E为![]() ,含有官能团为羧基,B结构简式为
,含有官能团为羧基,B结构简式为![]() ,故答案为:羧基;
,故答案为:羧基;![]() ;
;
(2) B发生水解反应生成C为![]() ,其反应类型为:取代反应(或水解反应);G发生加聚反应生成J为
,其反应类型为:取代反应(或水解反应);G发生加聚反应生成J为![]() ,其反应类型为:加聚反应(或聚合反应);
,其反应类型为:加聚反应(或聚合反应);
(3)①E+F→H的化学方程式为:![]() +CH3CH(OH)CH3
+CH3CH(OH)CH3![]()
![]() +H2O;
+H2O;
②D为![]() ,其与银氨溶液反应的化学方程式为:
,其与银氨溶液反应的化学方程式为:![]() +2Ag(NH3)OH
+2Ag(NH3)OH![]()
![]() +2Ag+3NH3+H2O;
+2Ag+3NH3+H2O;
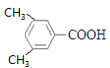
(4) E的同系物K比E相对分子质量大28,则K的分子式为:C9H10O2,与E属于同系物,则含有羧基,且属于芳香族化合物, 则按苯环上的取代基个数分类讨论如下:①苯环上有一个取代基,则结构简式为![]() 、
、![]() ;②苯环上有两个取代基,则可以是-CH2CH3和-COOH,也可以是-CH2COOH和-CH3,两个取代基的位置可以是邻间对,共2
;②苯环上有两个取代基,则可以是-CH2CH3和-COOH,也可以是-CH2COOH和-CH3,两个取代基的位置可以是邻间对,共2![]() 3=6种;③苯环上有三个取代基,则为2个-CH3和1个-COOH,定“二”议“一”其,确定其结构简式可以为:
3=6种;③苯环上有三个取代基,则为2个-CH3和1个-COOH,定“二”议“一”其,确定其结构简式可以为: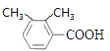 、
、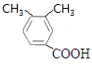 、
、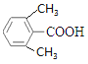 、
、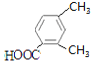 、
、 和
和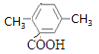 共6种,综上情况可知,K的结构简式有2+6+6=14种;其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式是
共6种,综上情况可知,K的结构简式有2+6+6=14种;其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式是 或
或 ,
,
故答案为:14;  或
或 (任意一种)。
(任意一种)。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
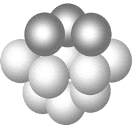
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
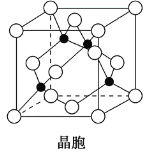
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以溴代芳烃A为原料发生如图转化,下列说法中错误的是
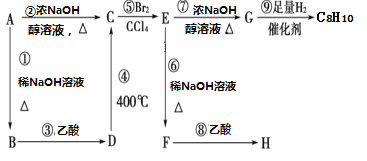
A. 合适的原料A可以有两种B. 转化中发生消去反应的是②⑦
C. C的名称为苯乙烯D. 转化中发生取代反应的是①③⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g)![]() 2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。
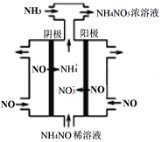
①其阴极的电极反应式为___________。
②常温下,1L pH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=________mol·L-1。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料的合成路线如下所示,请按要求作答:
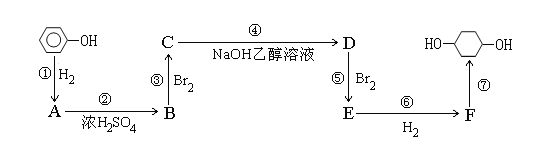
(1)写出A物质的名称:__________;步骤①至⑦中属于加成反应的是__________
(2)写出反应②④的化学反应方程式:
②__________________________________________________________________
④__________________________________________________________________
(3)反应⑤可以制得E,同时得到多种副产物,其中有一种副产物G的结构中只有3种不同的氢原子,副产物G发生图中⑦的反应生成有机物H,写出H结构简式为:__________
(4)1,3-丁二烯是应用广泛的有机化工原料,它还可以用来合成氯丁橡胶。结合以上信息写出以1,3-丁二烯为原料制备氯丁橡胶的单体![]() 的合成路线(必要的无机试剂可任选)。(示例:CH3CH2OH
的合成路线(必要的无机试剂可任选)。(示例:CH3CH2OH ![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br)___________________________
BrCH2CH2Br)___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要化工原料,其制备和有关性质如图所示。
(1)现要用如图所示的浓硫酸来配制步骤①中所需要的1mol/L的稀硫酸480ml,需要用这种浓硫酸的体积为______ml。
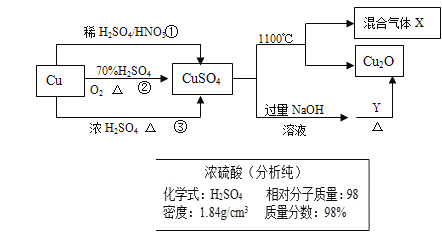
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒、烧杯外还有_______、__________。
(3)下列操作会使所配溶液浓度偏低的是 _________。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度 E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①②③中,途径_________能更好地体现绿色化学的思想。
(5)配制1000ml 0.1mol/L的硫酸铜溶液,需用托盘天平称取________g胆矾。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。
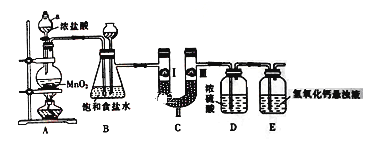
(1) 仪器a的名称为_______________。
(2) 装置B中饱和食盐水的作用是_________________;
(3) 写出A装置中发生反应的化学方程式______________________
(4) 装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入__________(填字母)。
选项 | a | b | c |
I | 湿润的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5) 装置E中氢氧化钙悬浊液的作用是___________________,同时该装置工业上可用来制取漂白粉,请写出相应反应的化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com