
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
分析 放电时,活泼的金属铝是负极,放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-;不活泼石墨为正极,原电池中阳离子向正极移动,在二次电池充电时,阴极得电子发生还原反应,电镀时,镀件为阴极,镀层金属为阳极,钢制品连接外加电源的负极.
解答 解:A、放电时,活泼的金属铝是负极,不活泼石墨为正极,放电时,有机阳离子通过电解质溶液(内电路)向正极石墨电极方向移动,故A错误;
B、电镀时,镀件为阴极,镀层金属为阳极,钢制品连接外加电源的负极,故B错误;
C、电池充电时,阴极得电子反应还原反应,电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-,故C正确;
D、若改用NaOH溶液作电解液,生成物为偏铝酸钠,不是氢氧化铝,故D错误.
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,要求理解原理,书写电解方程式,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
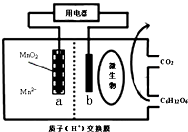
| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
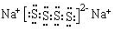 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素位于元素周期表中的同一周期 | |
| B. | X、Y、Z三种元素的原子半径依次减小 | |
| C. | X、Y、Z三种元素的原子序数大小为Y>Z>X | |
| D. | 若m>n.则Xm+的半径大于Zn+的半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
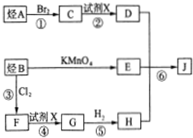
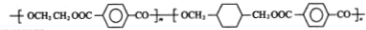
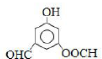 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、CO32-、Br-、ClO-能大量共存 | |
| B. | 不能用稀硝酸酸化的硝酸钡溶液检验该溶液是否变质 | |
| C. | 将此溶液与稀硫酸产生的少量气体通入足量的NaAlO2溶液中制Al(OH)3:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32- | |
| D. | 能使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com