
| A、Ba2+ |
| B、OH- |
| C、Cu2+ |
| D、Al3+ |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ | ||||
| B、向含有Fe2O3悬浊液中通入HI气体:Fe2O3+6H+=2Fe3++3H2O | ||||
C、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| D、等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(ml) | 标准盐酸体积(ml) | |
| 滴定前刻度(ml) | 滴定后刻度(ml) | ||
| 第一次 | 10.00 | 0.20 | 20.50 |
| 第二次 | 10.00 | 0.40 | 20.80 |
| 第三次 | 10.00 | 4.00 | 24.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2
制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:

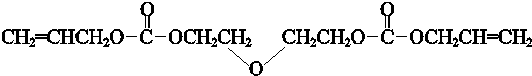
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和的食盐水中通气体的最合适的方法是先通CO2,再通NH3 |
| B、该反应能发生的原因是NaHCO3的溶解度在几种物质中最小 |
| C、若制得的”碱“中混有少量的NaHCO3,应用过量的NaOH溶液除去 |
| D、用酚酞试液可鉴别制得”碱“液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 常温下状态 | 溶解性 | 稳定性 |
| 白色固体 | 易溶于水和乙醇,难溶于CCl4 | 在干燥空气中稳定,在湿空气中放出氨转化为NH4HC03,59时分解为NH3和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:16 | B、16:1 |
| C、17:7 | D、7:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com