
分析 加入足量铁粉,则溶液中FeCl3、HCl、CuSO4完全反应生成FeCl2、FeSO4,反应后溶液中Fe2+的物质的量与原混合溶液中Cu2+的物质的量之比为2:1,设Cu2+的物质的量为n,则反应后溶液中Fe2+的物质的量为2n,根据反应Cu2++Fe=Cu+Fe2+可知,反应后生成的FeSO4的物质的量为n,则原溶液中硫酸根离子的物质的量为n;原溶液中FeCl3、HCl与Fe完全反应生成的FeCl2的物质的量为n,根据质量守恒可知Cl-的物质的量为:n(Cl-)=2n(FeCl2)=2n,再根据在同一溶液中c(SO42-):c(Cl-)=n(SO42-):n(Cl-)计算出原混合溶液中SO42-与Cl-的物质的量浓度之比.
解答 解:加入的铁粉足量,则溶液中FeCl3、HCl、CuSO4完全反应生成FeCl2、FeSO4,
反应后溶液中Fe2+的物质的量与原混合溶液中Cu2+的物质的量之比为2:1,设Cu2+的物质的量为n,则反应后溶液中Fe2+的物质的量为2n,
根据反应Cu2++Fe=Cu+Fe2+可知,反应后生成的FeSO4的物质的量为n,则硫酸根离子的物质的量为n,
原溶液中FeCl3、HCl与Fe完全反应生成的FeCl2的物质的量为n,根据质量守恒可知Cl-的物质的量为:n(Cl-)=2n(FeCl2)=2n,
由于在同一溶液中,则原溶液c(SO42-):c(Cl-)=n(SO42-):n(Cl-)=n:2n=1:2,
故答案为:1:2.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 同时减少 | B. | 同时增大 | C. | v(正)增大,v(逆)减少 | D. | v(正)减少,v(逆)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的简单离子均能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 碳酸溶液中的氢离子浓度是碳酸根离子浓度的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
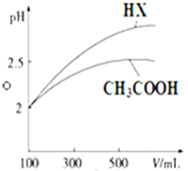 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
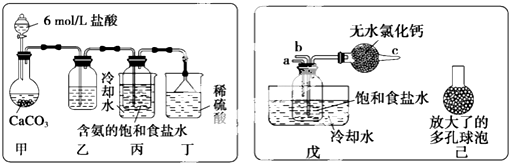
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| C. | 用酸性KMnO4溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| D. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com