
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 304 | 670 |
沸点/℃ | 132 | 173 | 316,易升华 | 700 |
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原少量无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为B→A→___→___→___→E(填字母,装置可多次使用);A中长颈漏斗的作用_____________。
③C中盛放的试剂是_____________。
(2)利用反应2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。

①仪器a的作用是__________。
②反应中提供过量氯苯的作用是__________。
③反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250 mL,量取25.00 mL所配溶液,用0.400 mol/L的NaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl C D C 平衡压强,便于观察装置是否有堵塞 碱石灰 冷凝回流,防止有机物挥发 促进反应正向进行,提高FeCl3的转化率 苯 蒸馏滤液 78.4%
2FeCl2+2HCl C D C 平衡压强,便于观察装置是否有堵塞 碱石灰 冷凝回流,防止有机物挥发 促进反应正向进行,提高FeCl3的转化率 苯 蒸馏滤液 78.4%
【解析】
(1)H2还原无水FeCl3制取FeCl2,用B装置H2,用A观察H2的流速并平衡气压,用C装置中的碱石灰干燥H2,干燥后的H2与无水FeCl3在D中发生反应:H2+2FeCl3![]() 2FeCl2+2HCl,为防止外界空气中的水蒸气进入D装置,D之后再连接一个C,最后用E装置处理尾气;
2FeCl2+2HCl,为防止外界空气中的水蒸气进入D装置,D之后再连接一个C,最后用E装置处理尾气;
(2)在A三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3 h,发生反应:2FeCl3+C6H5Cl![]() 2FeCl2+3C6H4Cl2+HCl↑,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5C1,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管,以此解答该题。
2FeCl2+3C6H4Cl2+HCl↑,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5C1,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管,以此解答该题。
(1)①H2还原无水FeCl3制取FeCl2的反应为:H2+2FeCl3![]() 2FeCl2+2HCl;
2FeCl2+2HCl;
②用B装置H2,用A观察H2的流速并平衡气压,A中长颈漏斗可以平衡压强,同时也便于观察装置是否有堵塞;用C装置干燥H2,干燥后的H2与无水FeCl3在D中发生反应,为防止外界空气中的水蒸气进入D装置,D之后再连接一个C,最后用E装置处理尾气,故按气流由左到右的方向,上述仪器的连接顺序为:BACDCE;A中长颈漏斗的作用是平衡压强,便于观察装置是否有堵塞;
③C的目的是干燥H2,用以吸收H2中的水蒸气,其盛放的试剂是碱石灰;
(2)①仪器a为球形冷凝管,其作用是冷凝回流,防止有机物挥发;
②在装置A会发生反应:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,在反应中使用过量的氯苯,可以促进反应正向进行,提高FeCl3的转化率;
2FeCl2+C6H4Cl2+HCl↑,在反应中使用过量的氯苯,可以促进反应正向进行,提高FeCl3的转化率;
③反应结束后,冷却实验装置A,三颈烧瓶内物质主要是产物FeCl2,还有过量的氯苯及副产物C6H4Cl2,由题可知,氯苯和副产物C6H4Cl2易溶于苯、乙醇而不溶于水,FeCl2不溶于苯、C6H5Cl、C6H4Cl2,,易溶于水和乙醇,易吸水,故洗涤所用的试剂可以是苯;回收滤液中C6H5Cl的操作方法是蒸馏滤液,并收集沸点132℃的馏分;
④根据Fe元素守恒,可知32.5 g无水氯化铁理论上生成FeCl2的物质的量为:n(FeCl2)=n(FeCl3)=![]() =0.2 mol,HCl消耗标准液NaOH的物质的量n(NaOH)=0.400 mol/L ×0.0196 L=7.84×10-3 mol,故根据反应方程式中物质转化关系可知反应生成的n(FeCl2)=2n(HCl)=2×7.84×10-3 mol×
=0.2 mol,HCl消耗标准液NaOH的物质的量n(NaOH)=0.400 mol/L ×0.0196 L=7.84×10-3 mol,故根据反应方程式中物质转化关系可知反应生成的n(FeCl2)=2n(HCl)=2×7.84×10-3 mol×![]() =0.1568 mol,所以FeCl3的转化率为
=0.1568 mol,所以FeCl3的转化率为![]() ×100%=78.4%。
×100%=78.4%。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、MgO和SiO2等物质。用硫酸铵固体等试剂提取粉煤灰中Al2O3并制取铝的工艺流程如图:
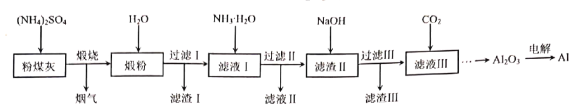
回答下列问题:
(1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为___。
(2)“滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为__、__。
(3)将“滤液Ⅱ”通过__、过滤、洗涤、干燥后得到的晶体可返回__工序中循环利用。
(4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为__。
(5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为__。
(6)某工厂利用上述流程从m吨粉煤灰中制得n吨Al2O3,则原粉煤灰中铝的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出符合下列要求的离子方程式:
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合_________________;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合____________________;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合____________________;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应______________________________;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A.0.1mol·L-1HR溶液的pH为5
B.当pH=6时,水电离出的氢离子浓度为1.0×10-6
C.当通入0.1 mol NH3时,c(![]() )>c(R-)>c(H+)>c(OH-)
)>c(R-)>c(H+)>c(OH-)
D.当 pH=7时,c(![]() )=c(R-)
)=c(R-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
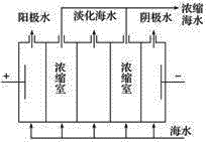
A.海水提溴的过程中,没有发生氧化还原反应
B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同
C.从海水中可以得到NaCl,电解NaCl溶液可制备金属钠
D.如图,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,此法称为电渗析法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
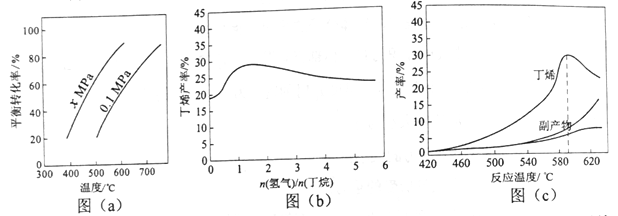
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是

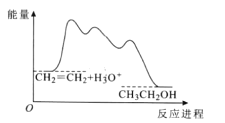
A.①、②、③三步反应均释放能量
B.该反应进程中有两个过渡态
C.第①步反应的活化能最小
D.总反应速率由第①步反应决定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com