
 �����������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣
�����������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣| ���� | H+ | K+ | Na+ | NH4+ | SO42�� | NO3�� | Cl�� |
| Ũ��/mol��L��1 | δ�ⶨ | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
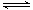 2NO(g) ��H
2NO(g) ��H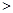 0
0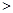 0���жϸ������ܷ�ʵ�ֲ����������ݣ� ��
0���жϸ������ܷ�ʵ�ֲ����������ݣ� �� 2XCO2+N2
2XCO2+N2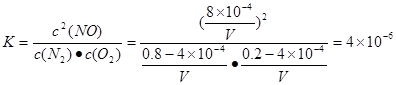 �����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ������Ϊ�����¶ȣ���ѧ��Ӧ���ʼӿ졣�ڸ�����֪������������غ㶨�ɿɵ÷�Ӧ����ʽΪ��2XCO+2NOX
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ������Ϊ�����¶ȣ���ѧ��Ӧ���ʼӿ졣�ڸ�����֪������������غ㶨�ɿɵ÷�Ӧ����ʽΪ��2XCO+2NOX  2XCO2+N2�������ڷ�Ӧ2CO��g��=2C��s��+O2��g����H>0�Ǹ���ϵ���ҳ̶ȼ�С�����ȷ�Ӧ����H>0����S<0��������ϵ�������ܦ�G=��H-T����S>0��.���Ը����벻��ʵ�֡�
2XCO2+N2�������ڷ�Ӧ2CO��g��=2C��s��+O2��g����H>0�Ǹ���ϵ���ҳ̶ȼ�С�����ȷ�Ӧ����H>0����S<0��������ϵ�������ܦ�G=��H-T����S>0��.���Ը����벻��ʵ�֡�


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��̼��Ʒֽ� |
| B������к� |
| C����̼�ڸ�������ˮ������Ӧ |
| D��Ba��OH��2?8H2O��NH4Cl�����壩�ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 FeO(s)+CO(g) ��H=akJ��mol-1,ƽ�ⳣ��ΪK;
FeO(s)+CO(g) ��H=akJ��mol-1,ƽ�ⳣ��ΪK; CO2(g) ��H=bkJ��mol-1;
CO2(g) ��H=bkJ��mol-1; 2Fe(s)+3CO2(g) ��H=ckJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
2Fe(s)+3CO2(g) ��H=ckJ��mol-1������ڲ�ͬ�¶���,Kֵ����:| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
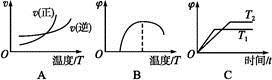
 2FeO(s)�Ħ�H= ��
2FeO(s)�Ħ�H= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��N2H4(g)��2H2O2(l)=N2(g)��4H2O(l)����H����817.63 kJ��mol��1 |
| B��N2H4(g)��2H2O2(l)=N2(g)��4H2O(g)����H����641.63 kJ��mol��1 |
| C��N2H4(g)��2H2O2(l)=N2(g)��4H2O(l)����H����641.63 kJ��mol��1 |
| D��N2H4(g)��2H2O2(l)=N2(g)��4H2O(g)����H����817.63 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CO2(g)+N2(g)
2CO2(g)+N2(g)




 CH3OH(g)����ƽ��ʱ�����CO��H2��CH3OH�ֱ�Ϊ1 mol��1 mol��1 mol�����������Ϊ3L�����������м���ͨ��3 mol CO����ʱv������ v���棩��ѡ���>������<������=�������жϵ����� ��
CH3OH(g)����ƽ��ʱ�����CO��H2��CH3OH�ֱ�Ϊ1 mol��1 mol��1 mol�����������Ϊ3L�����������м���ͨ��3 mol CO����ʱv������ v���棩��ѡ���>������<������=�������жϵ����� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)����H="-110.5" kJ��mol-1
CO(g)����H="-110.5" kJ��mol-1 CO2(g)����H="-283" kJ��mol-1
CO2(g)����H="-283" kJ��mol-1| A��172.5 kJ | B��1 149 kJ | C��283 kJ | D��517.5 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com