


科目:高中化学 来源: 题型:
| A、10 g H2和10 g O2 |
| B、5.6 LN2(标准状况)和11 g CO2 |
| C、9 g H2O和11.2 L(标准状况)苯 |
| D、224 mL H2(标准状况)和0.1 mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
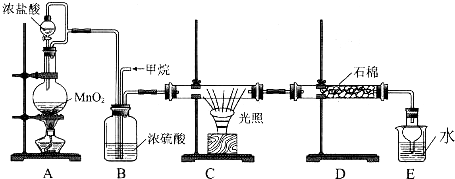
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料.如LiFePO4电池中某电极的工作原理如图:
(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料.如LiFePO4电池中某电极的工作原理如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯与溴化氢加成 |
| B、CH3CH2CH2Br与NaOH水溶液共热 |
| C、丙烯与氯气加成 |
| D、CH3CHBrCH2CH3与NaOH醇溶液共热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com