
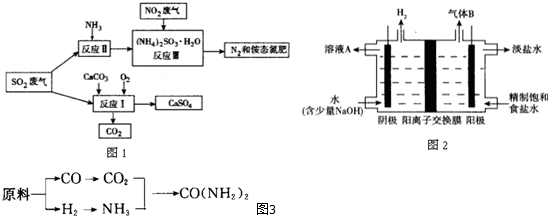
分析 (1)温度影响化学反应速率及化学平衡;工业生产中,以氨气为原料合成硝酸,是先将氨催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,据此写化学方程式;
(2)用原料所制得的H2和CO2的物质的量之比若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,原料的利用率最高,根据原料气产生的H2和CO2的物质的量之比判断;
(3)①根据反应物和生成物,写出反应Ⅰ的化学方程式;
②加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡;
(4)①二氧化硫和氢氧化钠反应生成NaHSO3;
②阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应.
解答 解:(1)合成氨反应的化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,在400~500℃的高温时,催化剂的催化活性最强,同时升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间;工业生产中,以氨气为原料合成硝酸,是先将氨催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,所以工业生产硝酸的最后一步的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:催化活性最强,增加反应速率,缩短达到平衡的时间; 3NO2+H2O=2HNO3+NO;
(2)NH3(换算成H2的物质的量)和CO2的物质的量之比为2:1合成尿素,即H2和CO2的物质的量之比为$\frac{2×3}{2}$:1=3:1.
甲厂以焦炭和水为原料,C+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+2H2,生成的H2和CO2的物质的量之比为2:1.
乙厂以天然气和水为原料,CH4+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+4H2,生成的H2和CO2的物质的量之比为4:1.
丙厂以石脑油和水为原料,C5H12+10H2O$\frac{\underline{\;高温\;}}{\;}$5CO2+16H2,生成的H2和CO2的物质的量之比为16:5,丙最接近3:1,
故答案为:丙;
(3)①根据反应物和生成物,写出反应Ⅰ的化学方程式为:2CaCO3+O2+2SO2=2CaSO4+2CO2,
故答案为;2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亚硫酸根离子易被氧化,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化,
故答案为:防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡(HCl 和 BaCl2),
故答案为:盐酸和氯化钡(HCl 和 BaCl2);
(4)①二氧化硫和氢氧化钠反应生成NaHSO3,SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O),
故答案为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O);
②阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应,SO2+Cl2+H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+H2O=4H++SO42-+2Cl-.
点评 本题考查了影响化学反应速率的因素,化学方程式的计算,离子反应等,考查的知识点较多,结合性强,题目难度中等,试题能够提高学生的分析、理解能力及计算能力.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
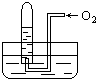 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: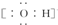 | |
| C. | 氯原子的结构示意图: | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 在 CuSO4溶液中加入一小块Na | Na溶解,生成沉淀 | 有Cu产生 |
| B | 将浓氨水滴加至烧瓶中的CaO上 | 产生的气体可使湿润的红色石蕊试纸变蓝 | 有氨气生成 |
| C | 在Fe(NO3)2溶液中加入稀H2SO4 | 溶液变为黄色 | 稀H2SO4具有氧化性 |
| D | 将氨气通入I2-淀粉溶液中 | 溶液蓝色褪去 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com