
 .
. 分析 X元素原子的L层电子数是K层电子数的3倍,则X为O元素;Y元素原子核外电子层数等于原子序数,则Y为H元素;Z元素原子L层电子数是K层和M层电子数之和,则Z为S元素;W元素原子的最外层电子数是次外层电子数的2.5倍,则W为N元素,据此答题.
解答 解:X元素原子的L层电子数是K层电子数的3倍,则X为氧元素;Y元素原子核外电子层数等于原子序数,则Y为氢元素;Z元素原子L层电子数是K层和M层电子数之和,则Z为硫元素,硫的原子结构示意图为 ,W元素原子的最外层电子数是次外层电子数的2.5倍,则W为氮元素,
,W元素原子的最外层电子数是次外层电子数的2.5倍,则W为氮元素,
故答案为:氧;氢;硫;氮; .
.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
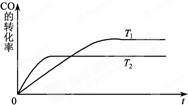 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
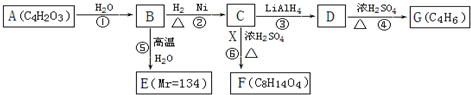
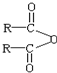 $\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH ,1molA和足量的H2反应最多消耗掉H2的物质的量为1mol.
,1molA和足量的H2反应最多消耗掉H2的物质的量为1mol.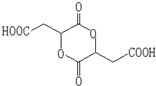 .
.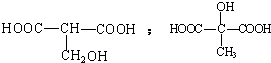 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g/mol | B. | 60g/mol | C. | 90g/mol | D. | 120g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com