
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |
分析 X、Y两元素可形成X2Y3型化合物,可判断X的可能化合价为+3价,Y的可能化合价为-2价,由此判断最外层电子.
解答 解:A.X为Al元素,Y为Cl元素,组成的化学为AlCl3,故A错误;
B.当X的电子排布为2s22p3时,为N元素,Y为O元素,能形成氮的氧化物N2O3,但是共价化合物,故B错误;
C.当X的电子排布为3s23P1时,为Al元素,Y为O元素,能形成Al2O3型离子化合物,故C正确;
D.X为Mg元素,Y为N元素,形成化合物为X3Y2,不符合题意,故D错误.
故选C.
点评 本题考查原子核外电子排布,题目难度不大,注意根据化合物的类型判断可能的化合价,由此推断可能的核外电子排布.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
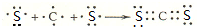 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl互为同位素 | |
| D. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl是两种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sn2+、Fe2+、Ce3+ | B. | Fe2+、Ce3+、Sn2+ | C. | Fe2+、Sn2+、Ce3+ | D. | Ce3+、Fe2+、Sn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体,生成Cu(NO3)2 | |
| C. | 与Na2CO3反应放出CO2气体,生成NaNO3 | |
| D. | 与S单质混合共热时生成H2SO4和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
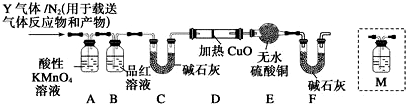
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
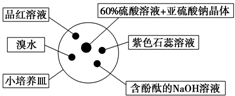 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na、K的原子半径一次增大 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | HF、HCl、HBr、HI的沸点依次增高 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com