
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________。
(3)滤渣1和滤渣3主要成分的化学式分别是________________,_____________。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________。
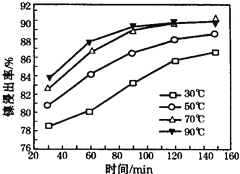
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
【答案】 增大接触面积,提高浸出速率和产率(或浸出率) 5.0≤pH<6.7 SiO2、CaSO4 CaF2 2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O NiS + H2SO4 + 2HNO3 == NiSO4 + SO2↑+ 2NO↑ + 2H2O 70 120
【解析】含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2将亚铁离子氧化为Fe3+,再加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是:增大接触面积,提高浸出速率和产率(或浸出率);(2)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中数据,调节pH的范围为5.0≤pH<6.7;(3)滤渣1和滤渣3主要成分的化学式分别是:滤渣1为SiO2、CaSO4 ,滤渣3为CaF2;(4)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,起反应的离子方式为:2Fe2++H2O2+2H+═2Fe3++2H2O;(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体,即生成NO和SO2,该反应的化学方程式为 NiS + H2SO4 + 2HNO3 == NiSO4 + SO2↑+ 2NO↑ + 2H2O;(6)由图象可知,为70℃、120min时,镍浸出率最高。


科目:高中化学 来源: 题型:
【题目】右图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
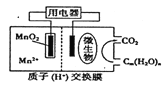
A. 正极反应式为MnO2+4H++2e-===Mn2++2H2O
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池阴极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2![]() 2NH3,2NH3+CO2
2NH3,2NH3+CO2![]() H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:
(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为______,Zn位于元素周期表的_______区。
(2)C、N、O三种元素第一电离能从大到小的顺序是___________。
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是____________,原因: ___________。
(4)尿素分子中,原子杂化轨道类型有____________,σ键与π键数目之比为_______。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表亓晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(![]() ),则E原子的坐标参数为_____。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为______pm。(
),则E原子的坐标参数为_____。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为______pm。(![]() )
)
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表达式为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
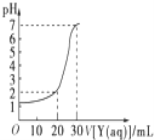
A | B | C | D | |
HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关人体中水和无机盐的叙述,错误的是 ( )
A. 血浆中含有水 B. 自由水是细胞内的良好的溶剂
C. 血红蛋白中含有铁元素 D. 细胞中一定没有无机盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y的摩尔质量相同,Y为淡黄色固体,N常温下是液体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
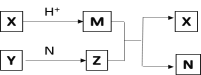
A. 相对分子质量M>N,沸点M>N
B. 原子半径:D>B>C>A
C. Z 为 NaOH
D. M是一种非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Cl2(HCl) | 饱和食盐水 | 洗气 |
B | NaBr溶液(NaI) | Cl2 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | HNO3溶液(H2SO4) | BaCl 2溶液 | 过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )

A. 浓H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
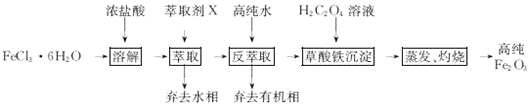
已知:HCl(浓)+FeCl3![]() HFeCl4
HFeCl4
试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca、Mn、Cu等杂质离子几乎都在 (填“水”或“有机”)相。
②若实验时共用萃取剂X 120 mL,萃取率最高的方法是 (填字母)。
a.一次性萃取,120 mL
b.分2次萃取,每次60 mL
c.分3次萃取,每次40 mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是 (写化学式);反萃取能发生的原因是 。
(3)所得草酸铁沉淀需用冰水洗涤,其目的是 。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式,并用单线桥标出电子转移的方向和数目 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com