
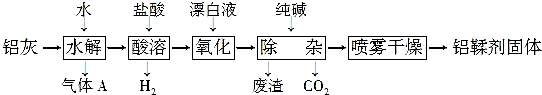
分析 铝灰主要成分为Al、Al2O3、AlN、FeO等,加水发生反应,AlN发生水解生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,采用喷雾干燥制备铝鞣剂.
(1)AlN水解得到气体A是氨气,加热可以促进氮化铝水解生成氨气,有利于氨气的逸出;
(2)酸溶时使用的酸是盐酸;
(3)加入漂白液的作用是利用次氯酸根离子在酸溶液中的强氧化性,将氧化亚铁离子为铁离子;
(4)由上述分析可知滤渣为氢氧化铁沉淀;可以回收利用生成铁红;
(5)铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解;
(6)最终得到ng沉淀为AgCl的质量,根据氯离子守恒计算Al(OH)2Cl的质量,进而计算样品中Al(OH)2Cl的质量分数.
解答 解:铝灰主要成分为Al、Al2O3、AlN、FeO等,加水发生反应,AlN发生水解生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,采用喷雾干燥制备铝鞣剂.
(1)AlN水解得到气体A是NH3,加热可以加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出,
故答案为:NH3;加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出;
(2)由流程图可知,酸溶时使用的酸是盐酸,
故答案为:盐酸;
(3)加入漂白液的作用是利用次氯酸根离子在酸溶液中的强氧化性,将氧化亚铁离子为铁离子,反应离子方程式为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O,
故答案为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O;
(4)由上述分析可知,滤渣为Fe(OH)3沉淀;可以回收利用生成铁红,
故答案为:Fe(OH)3;回收利用生成铁红;
(5)铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解,
故答案为:防止Al(OH)2Cl水解生成Al(OH)3;
(6)最终得到ng沉淀为AgCl的质量,根据氯离子守恒,Al(OH)2Cl的质量=$\frac{ng}{143.5g/mol}$×96.5g/mol,故样品中Al(OH)2Cl的质量分数为($\frac{ng}{143.5g/mol}$×96.5g/mol÷mg)×100%=$\frac{193n}{287m}$×100%,
故答案为:$\frac{193n}{287m}$×100%.
点评 本题考查物质准备工艺流程,涉及对操作的分析评价、对条件控制分析、物质含量测定等,熟练掌握元素化合物知识,树立资源回收再利用意识,是对学生综合能力的考查.题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 二氧化碳与足量的氢氧化钠反应:CO2+2OH-═CO32-+H2O | |
| C. | 大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁 1,4-二甲基丁 | B. | 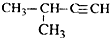 3-甲基丁炔 3-甲基丁炔 | C. | 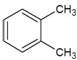 二甲基苯 二甲基苯 | D. | 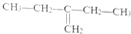 2-乙基-1-丁烯 2-乙基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
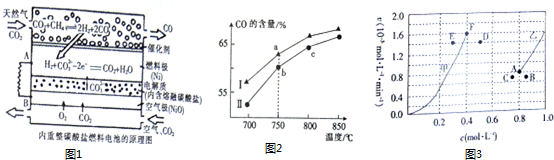
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  氧化剂 | B. |  爆炸品 | C. |  剧毒品 | D. |  遇湿易燃物品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
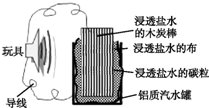 利用生活中常见的材料可以进行很多科学实验,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法中正确的是( )
利用生活中常见的材料可以进行很多科学实验,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法中正确的是( )| A. | 铝罐不会被腐蚀 | |
| B. | 木炭棒上发生的反应为O2+2H2O+4e-═4OH- | |
| C. | 木炭棒应与玩具电机的负极相连 | |
| D. | 该电池工作一段时间后木炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com