
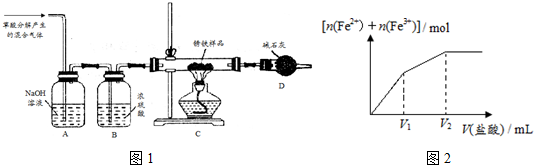
分析 (1)①钢铁在潮湿空气中发生电化学腐蚀时,其负极铁发生氧化反应生成亚铁离子;
②装置A为氢氧化钠溶液,氢氧化钠溶液能够与二氧化碳反应,利用氢氧化钠溶液将混合气体中的二氧化碳除去;装置B中为浓硫酸,浓硫酸能够吸收混合气体中的水分;
③根据锈铁样品12.6g、固体的质量为8.4g为铁的质量、装置D增重8.4g为二氧化碳和水的质量,根据以上数据可以计算出铁锈组成;
④根据一氧化碳有毒,不能排放到空气中进行解答;
(2)根据浓硫酸吸收水和碱石灰吸收水和二氧化碳,求出二氧化碳的质量,然后根据二氧化碳求出氧化铁的质量,从而求出x的值;再根据样品总质量计算出m(Fe):m (Fe2O3•xH2O);
(3)氧化铁先与盐酸反应,根据氧化铁、铁与盐酸反应方程式判断消耗相同的氯化氢生成铁离子、亚铁离子的物质的量大小,然后根据图象进行判断二者物质的量关系.
解答 解:(1)①钢铁在潮湿空气中发生电化学腐蚀时,其负极铁发生氧化反应生成亚铁离子,电极反应式为 Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
②根据实验目的,需要使用一氧化碳还原氧化铁晶体,所以需要将草酸分解生成的二氧化碳和水除去,装置A中的氢氧化钠溶液用于除去二氧化碳气体,装置B中的浓硫酸用于干燥一氧化碳气体,
故答案为:除去混合气体中的CO2;除去混合气体中的H2O;
③加热完全反应后得到固体的质量为8.4g为铁的质量,装置D增重8.4g为二氧化碳和水的质量,再经过样品的总质量可以计算出铁锈组成,
故答案为:能;
④一氧化碳有毒,不能排放到空气中,所以应该增加尾气处理装置,
故答案为:缺少尾气处理装置;
(2)浓硫酸吸收水,碱石灰吸收水和二氧化碳.取锈铁样品12.6g置于装置D的硬质玻璃管中,加热一段时间至完全反应后得到固体的质量为8.4g,装置E增重8.4g.若将装置E换成装浓硫酸的洗气瓶F,重新按上述样品的用量和操作进行实验,若完全反应后得到固体的质量仍为8.4g,而装置F增重1.8g.所以水的质量为1.8g,二氧化碳的质量为8.4g-1.8g=6.6g,设氧化铁的质量为y,
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
y 6.6g
$\frac{160}{y}$=$\frac{132}{6.6}$,
y=8g
则氧化铁和水的分子个数比=$\frac{8g}{160}$=$\frac{1.8g}{18}$=1:2,所以x=2;
样品中铁的质量为:12.6g-(8g+1.8g)=2.8g,所以样品中铁单质和Fe2O3•xH2O的质量比为:2.8g:(8g+1.8g)=2:7,
故答案为:2;2:7;
(3)0~V1段发生的反应为Fe2O3+6HCl=2FeCl3+3H2O、Fe+2FeCl3=3FeCl2,正反应为:Fe+Fe2O3+6HCl=3FeCl2+3H2O,V1~V2段铁或者氧化铁有一种物质过量;由Fe+2HCl=FeCl2+H2↑可知,2mol氯化氢生成1mol亚铁离子,由Fe2O3+6HCl=2FeCl3+3H2O可知,6mol的氯化氢可以生成2mol的Fe3+,显然消耗相同物质的量盐酸时,铁与盐酸反应增加的亚铁离子比氧化铁增加的铁离子物质的量大,由于V1~V2铁离子和亚铁离子总的物质的量增大幅度小于0~V1,说明V1~V2段为氧化铁与盐酸的反应,即氧化铁的物质的量大于铁的物质的量,故c正确,
故答案为:c.
点评 本题考查了探究物质组成及测量物质含量的方法、铁的氧化物和氢氧化物的性质,题目难度较大,注意掌握探究物质组成、测量物质含量常用方法,(3)为易错点,注意铁与氧化铁混合物与盐酸的反应情况.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
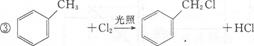
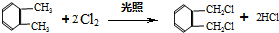 .
.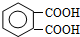 +2CH3CH2OH
+2CH3CH2OH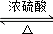
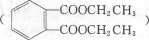 +2H2O.
+2H2O.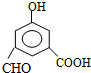 ,每种同分异构体中,化学环境不同的氢原子都是6种.
,每种同分异构体中,化学环境不同的氢原子都是6种.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入足量NH3,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 盛放氢氧化钠溶液的试剂瓶用橡皮塞,不用玻璃塞 | |
| D. | Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为0.2 mol/L | B. | Y为0.1 mol/L | ||
| C. | Z为0.4 mol/L | D. | Z为0.1 mol/L时,Y为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| B. | C-O键的极性比N-O键的极性大 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com