
分析 (1)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl;
(2)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液;由④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
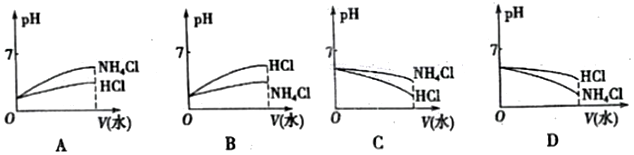
(3)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,盐酸为强电解质,则pH变化程度大,而稀释时促进氯化铵中铵根离子水解,则pH变化小.
解答 解:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,故答案为:NH4Cl;
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4C1 和 NH3•H2O;
④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4C1 和 NH3•H2O;NH4Cl和HCl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,
故答案为:B.
点评 本题考查离子浓度大小的比较,题目较难,考查学生利用离子的关系来分析溶液中的溶质,明确溶液中的电离和水解是解答本题的关键,并注意(3)是学生解答的难点,与强酸、弱酸的稀释相似.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油存放过久,会有一种难闻的“哈喇”味,但不影响食用 | |
| B. | 葡萄糖能发生水解反应 | |
| C. | 淀粉和纤维素水解的最终产物是葡萄糖 | |
| D. | 氨基酸分子中含有氨基和羧基,因此具有两性,但蛋白质没有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
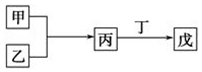 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则上述反应可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙一定是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
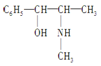 麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
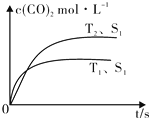 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com