
| A. | 能使石蕊溶液呈红色的溶液:Fe2+、Na+、Ba2+、Cr2O72-可以大量共存 | |
| B. | 氢氧化钡溶液与等物质的量的稀硫酸混合,离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 50℃,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 25℃,pH相同的NaOH、CH3COONa、Na2CO3、NaHCO3溶液的浓度c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
分析 A.使石蕊溶液呈红色的溶液呈酸性;
B.离子配比数不正确;
C.根据pH=-lgc(H+)计算;
D.CH3COONa水解程度最小,浓度应最大.
解答 解:A.使石蕊溶液呈红色的溶液呈酸性,酸性条件下Fe2+、Cr2O72-发生氧化还原反应,故A错误;
B.离子配比数不正确,应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B错误;
C.pH=-lgc(H+)=1,则c(H+)=0.1mol/L,故C正确;
D.NaHCO3水解程度最小,CH3COONa浓度应最大,故D错误.
故选C.
点评 本题考查较为综合,涉及离子共存,离子方程式的书写以及pH的计算等问题,侧重于学生的分析、计算能力的考查,注意把握物质的性质以及离子方程式的书写方法,难度不大.


科目:高中化学 来源: 题型:解答题
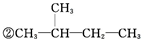 ③CH2=CH2④
③CH2=CH2④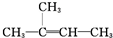 ⑤CH≡CH⑥CH3-C≡CH ⑦CH3-Cl ⑧CH3-CH2-Br⑨CH3-OH ⑩CH3-CH2-OH⑪CH3-COOH⑫CH3-COO-CH2-CH3⑬
⑤CH≡CH⑥CH3-C≡CH ⑦CH3-Cl ⑧CH3-CH2-Br⑨CH3-OH ⑩CH3-CH2-OH⑪CH3-COOH⑫CH3-COO-CH2-CH3⑬ ⑭
⑭ ⑮
⑮ ⑯
⑯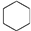
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
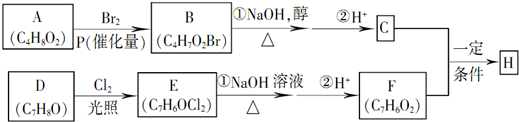
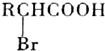
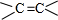 ;
;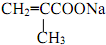 +NaBr+2H2O,该反应的类型为消去反应;
+NaBr+2H2O,该反应的类型为消去反应; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.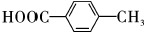 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
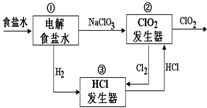 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

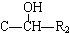 (R代表烃基或氢原子,下同.)
(R代表烃基或氢原子,下同.)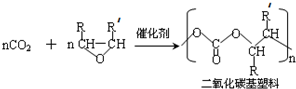
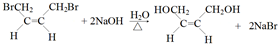 ,反应④的化学反应方程式
,反应④的化学反应方程式 ,反应⑤的化学反应方程式
,反应⑤的化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”的同分异构体有( )
”的同分异构体有( )| A. | 7种 | B. | 9种 | C. | 11种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol FeBr2与足量氯气反应时,理论上转移的电子数约为3×6.02×1023 | |
| B. | 常温下,pH均为3的三种溶液:①HCl溶液 ②H2SO4溶液③CH3COOH溶液,各自溶质的物质的量浓度大小顺序为①=②<③ | |
| C. | 电解熔融NaCl或AlCl3制取Na或Al | |
| D. | 一定条件下反应Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)达到平衡后,滴加少量浓硫酸,重新达平衡前,2v正(Cr2O72-)<v逆(CrO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com