
分析 C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)同周期自左而右电负性增大,Cl元素氧化物中氧元素表现负价,四种元素电负性最大的为O元素;C为P元素,原子核外电子数为15,根据能量最低原理书写核外电子排布式;
(2)A为O元素,有O2、O3两种同素异形体,均形成分子晶体,相对原子质量较大,分子间作用力越大,物质的沸点越高;
(3)C和D反应可生成化合物为PCl3,P原子形成3个P-Cl键,含有1对孤对电子;
(4)化合物D2A为Cl2O,计算O原子孤电子对数、价层电子对数,价层电子对数=δ键数目+孤电子对数,进而确定空间构型;氯气与湿润的Na2CO3反应得到Cl2O,由电子转移守恒可知,先得到HCl生成,HCl再与碳酸钠反应.
解答 解:C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)同周期自左而右电负性增大,Cl元素氧化物中氧元素表现负价,四种元素电负性最大的为O元素;C为P元素,原子核外电子数为15,根据能量最低原理原理,核外电子排布式为:1s22s22p63s23p3,
故答案为:O;1s22s22p63s23p3;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对原子质量较大,则范德华力较大,沸点较高,
故答案为:O3;O3相对原子质量较大,范德华力较大;
(3)C和D生成组成比为1:3的化合物E为PCl3,P原子形成3个P-Cl键,含有1对孤对电子,立体构型为为三角锥形,杂化轨道数目为3,P原子采取sp3杂化,
故答案为:三角锥形;sp3;
(4)化合物D2A为Cl2O,O为中心原子,形成2个σ键,孤电子对数为$\frac{6-1×2}{2}$=2,则中心原子的价层电子对数为4,立体构型为V形,
氯气与湿润的Na2CO3反应得到Cl2O,由电子转移守恒可知,先得到HCl生成,HCl再与碳酸钠反应,反应的方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl),
故答案为:V形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl).
点评 本题是对物质结构与性质的考查,涉及核外电子排布、沸点比较、杂化方式与空间构型判断、化学方程式书写等,侧重考查学生的分析能力,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 中子数是136 | B. | 质量数222 | C. | 电子数86 | D. | 质子数136 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
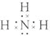 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
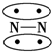 ,CO的结构可以表示为
,CO的结构可以表示为 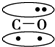 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA | |
| B. | 0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA | |
| C. | 1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
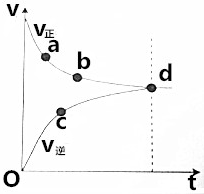
| A. | 起始只投入Fe(CO)5 | |
| B. | d点表示该反应达到限度 | |
| C. | 到达d点后,CO的浓度不变 | |
| D. | 反应过程中,CO的正反应速率逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
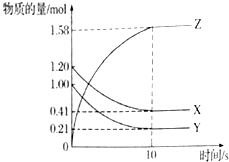 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com