
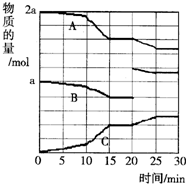
| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
分析 A.10~15min未到达平衡,且改变条件,速率增大,反应进行向正反应进行,可能为使用催化剂或升高温度或增大压强;
B.10~15min,反应速率增大,如果降低温度,反应速率会减小;
C.20min时若缩小了容器体积,则20min时B的物质的量不会变化;
D.20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应增大B的物质的量,可能是增加了B的量.
解答 解:A.根据图象可知,10~15min未到达平衡,且改变条件后,反应速率都增大,反应向着正反应方向进行,可能为使用催化剂或升高温度或增大压强,不可能扩大了容器容积(减小压强),故A正确;
B.10~15min未到达平衡,且改变条件,反应速率都增大,若降低温度反应速率减慢,故B错误;
C.20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应增大B的物质的量;如果缩小容器体积,则20min时B的物质的量不会变化,故C错误;
D.20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应该是增大了B的物质的量,故D正确;
故选D.
点评 本题考查了物质的量或浓度随时间变化的曲线,题目难度中等,明确图象曲线变化的含义为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦ | B. | ①②③⑥⑦ | C. | ①②④⑦ | D. | ②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
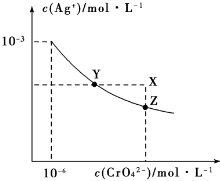 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点 | |
| B. | 在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃ | |
| C. | 向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点 | |
| D. | 在t℃时,Ag2CrO4的Ksp为1×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
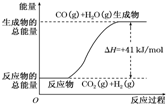 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
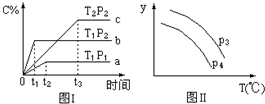
| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,当两种沉淀共存时,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com