
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________;写出制备反应的化学方程式:____________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
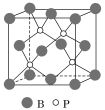
①磷化硼晶体属于______________晶体(填晶体类型),____________(填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________。
③已知BP的晶胞边长为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为____________g·cm-3(用含a、NA的式子表示)。
【答案】![]() CO32-或NO3- < sp2 正四面体 TiCl3+3LiBH4=Ti(BH4)3+3LiCl 原子 是 4
CO32-或NO3- < sp2 正四面体 TiCl3+3LiBH4=Ti(BH4)3+3LiCl 原子 是 4 ![]()
【解析】
(1)硼处于第二周期ⅢA族,其2s、2p电子为其价电子;
(2)等电子体原子个数相等、价电子数相等;
(3)①根据元素周期律,同周期元素从左向右第一电离能逐渐增大;H2N →BH2中N原子的价层电子对数为3,据此判断杂化类型;
②根据BH4-中B原子的杂化方式可知其立体构型;根据元素守恒书写化学方程式;
(4)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合性质可知其晶体类型,硼最外层有3个电子,但根据晶胞结构可知,每个硼和磷周围都有4个共价键,所以磷原子含有孤电子对,硼原子含有空轨道,它们之间存在配位;
②根据晶的结构图可知,每个磷原子周围有4个硼原子;
③BP的晶胞边长为anm=a×10-7cm,其体积为(a×10-7cm)3,根据晶胞图可知,每个晶胞中含有B原子数为4,P原子数为8×![]() +6×
+6×![]() =4,根据ρ=
=4,根据ρ=![]() 计算。
计算。
(1)硼是五号元素,价电子数为3,原子的价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)原子总数相同,价电子总数也相同的粒子互为等电子体,所以由第二周期元素组成的与BCl3互为等电子体的阴离子为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(3)①根据元素周期律,同周期元素从左到右第一电离能逐渐增大,所以B的第一电离能小于N的第一电离能;H2N→BH2中B原子的价层电子对数为![]() ,所以B原子杂化类型为sp2;故答案为:<;sp2;
,所以B原子杂化类型为sp2;故答案为:<;sp2;
②![]() 中B原子的价层电子对数为
中B原子的价层电子对数为![]() ,所以杂化方式为sp3杂化,则
,所以杂化方式为sp3杂化,则![]() 的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4=Ti(BH4)3+3LiCl,故答案为:正四面体;TiCl3+3LiBH4=Ti(BH4)3+3LiCl;
的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4=Ti(BH4)3+3LiCl,故答案为:正四面体;TiCl3+3LiBH4=Ti(BH4)3+3LiCl;
(4)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合耐磨的性质可知其晶体类型为原子晶体;硼原子最外层有3个电子,但根据晶胞结构可知,每个硼周围都有4个共价键,所以存在配位键,故答案为:原子;是;
②根据晶胞结构可知,每个磷原子周围有4个硼原子,所以配位数为4,故答案为:4;
③BP的晶胞边长为a nm=a×10-7 cm,其体积为(a×10-7 cm)3,根据晶胞结构可知,每个晶胞中含有P原子数为4,B原子数为8×![]()
![]() =4,所以磷化硼晶体的密度为
=4,所以磷化硼晶体的密度为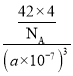 g·cm-3=
g·cm-3=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量最多的元素,Q的核电荷数是X与Z的核电荷数之和,E是元素周期表中电负性最大的元素。请回答下列问题:
(1)X、Y的元素符号依次为__________、__________。
(2)![]() 与
与![]() 分别属于__________(填“极性分子”或“非极性分子”,下同)和__________。
分别属于__________(填“极性分子”或“非极性分子”,下同)和__________。
(3)Q的元素符号是__________,它位于第__________周期,它的基态原子的核外电子排布式为____________________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示,与氢气发生加成反应得到物质甲,下列有关说法错误的是( )
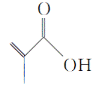
A.有机物M含有2种官能团
B.有机物M的分子式为C4H6O2
C.有机物M能发生取代反应、加聚反应
D.甲的只含有一种官能团的链状同分异构体有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其隔绝空气加热到200 ℃开始分解为FeO和CO2,若将其在空气中高温煅烧则生成Fe2O3。
(1)已知25 ℃、101 kPa时:
①C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
②铁及其化合物反应的焓变示意图如图:
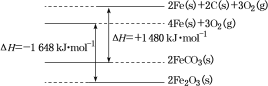
请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式:___________。
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其化学方程式为Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g) ΔH
2Fe(s)+3CO(g)+6H2(g) ΔH
①反应在3 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量减少4.8 g,则该段时间内用H2表示该反应的平均反应速率为________________。
②将一定量的Fe2O3(s)和CH4(g )置于恒温恒容密闭容器中,在一定条件下反应,能说明反应达到平衡状态的是____________。
A CO和H2的物质的量之比为1∶2
B 混合气体的密度不再改变
C 铁的物质的量不再改变
D v正(CO)=2v逆(H2)
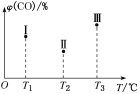
③在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同的密闭容器中加入足量“纳米级”的金属铁,然后分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时,CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是________;上述反应的ΔH________0(填“大于”或“小于”)。
(3)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
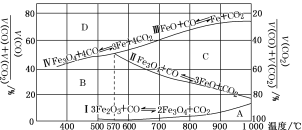
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
若在800 ℃,混合气体中CO2体积分数为40%的条件下,Fe2O3用CO还原焙烧,写出反应的化学方程式:__________。
(4)Fe2O3还可以用来制备FeCl3,通过控制条件FeCl3可生成聚合物,其离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+。下列措施不能使平衡正向移动的是________(填字母)。
+yH+。下列措施不能使平衡正向移动的是________(填字母)。
A 加水稀释 B 加入少量铁粉
C 升温 D 加入少量Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958 kJ/mol、INi=1753 kJ/mol,ICu>INi的原因是_____________________。
(2)某镍白铜合金的立方晶胞结构如图所示。
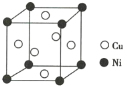
①晶胞中铜原子与镍原子的数量比为________。
②合金的密度为d g/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
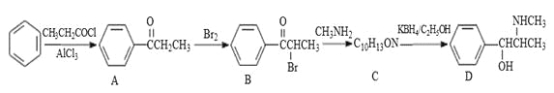
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1的氨水中含有的NH3 分子数为 0.1 NA
B.标准状况下, 2.24 L 的 CCl4 中含有的 C-Cl 键数为 0.4 NA
C.14 g 由乙烯与环丙烧 ( C3H6) 组成的混合气体含有的碳原子数目为NA
D.常温常压下, Fe 与足量稀盐酸反应生成 2.24 L H2, 转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能产生对应实验现象的是
实验操作 | 实验现象 | |
A | 用玻璃棒蘸取氯化铵溶液,点在红色石蕊试纸上 | 试纸变蓝色 |
B | 向盛有 K2Cr2O7 溶液的试管中滴加浓硫酸,充分振荡 | 溶液由橙黄色逐渐变为黄色 |
C | 向 FeCl3 溶液中加入 KI 溶液,再加入苯,充分振荡,静置 | 溶液分层,上层呈紫色 |
D | 向蔗糖在硫酸催化下水解后的溶液中,加入新制 氢氧化铜悬浊液并加热 | 出现砖红色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表示反应颜色变化的是
A.将盛有NO2的密封玻璃容器放入冷水中,颜色变浅:2NO2![]() N2O4
N2O4
B.用铝筷摩擦浸泡在NaCl溶液中变黑的银器(黑色物质为Ag2S),银器很快恢复银白色:Ag2S+2NaCl===Na2S+2AgCl
C.氯化亚铁溶液遇铁氰化钾溶液出现蓝色沉淀:3FeCl2+2K3[Fe(CN)6]===Fe3[Fe(CN)6]2↓+6KCl
D.FeCl3溶液中加入铜粉,溶液从黄色变为蓝绿色:2FeCl3+Cu===2FeCl2+CuCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com