
 ,该元素基态原子结构示意图
,该元素基态原子结构示意图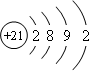 .该元素的名称为钪,形成的单质为金属晶体.
.该元素的名称为钪,形成的单质为金属晶体. 中心原子的杂化方式为
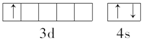
中心原子的杂化方式为分析 (1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,价电子排布式为3d14s2,根据原子序数画原子结构示意图,处于第四周期ⅢB族,为金属元素,属于金属晶体;
(2)根据配合物理论分析,配位体:提供孤电子对的分子或离子;配位原子:配体中,提供电子对的原子,配位数:中心原子周围的配位原子个数;
(3)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强;
(4)N原子价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
(5)不同非金属元素之间易形成极性键,正负电荷重心重合的分子为非极性分子;
(6)根据氢键进行分析,氢键影响晶体的熔沸点.
解答 解:(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,价电子排布式为3d14s2,其元素核外价电子排布图为:
 ,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,该元素的名称为钪,属于金属元素,形成金属晶体,
,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,该元素的名称为钪,属于金属元素,形成金属晶体,
故答案为: ;
; ;钪;金属;
;钪;金属;
(2)配合物K3[Co(CN)6]中的中心离子为Co3+、配位体是CN-、配位数为6;
故答案为:Co3+;CN-;6;
(3)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,
故答案为:>;
(4)氨气的电子式为 ,NH3分子中心N原子孤电子对数=$\frac{5-3×1}{2}$=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,故答案为:
,NH3分子中心N原子孤电子对数=$\frac{5-3×1}{2}$=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,故答案为: ,sp3;正四面体;三角锥形;
,sp3;正四面体;三角锥形;
(5)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
故选①③④⑦;
(6)水分子之间除了有范德华力还有氢键,而硫化氢分子之间只有范德华力,沸点高于同族其它元素氢化物,
故答案为:水分子之间除了有范德华力还有氢键,而硫化氢分子之间只有范德华力.
点评 本题是对物质结构的考查,涉及核外电子排布、分子结构与性质、价层电子对互斥理论等,难度中等,侧重对基础知识巩固.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
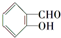 中含有苯环的所有同分异构体
中含有苯环的所有同分异构体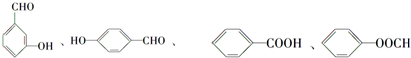
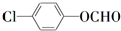 (写结构简式).
(写结构简式).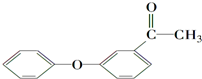 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件: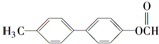 (写出一个就可以)
(写出一个就可以)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
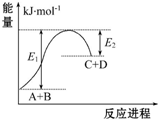
| A. | 该反应为放热反应 | |
| B. | 该反应吸收的能量为(E1-E2) | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某实验小组对一含有Al3+的未知溶液进行了如下分析:
某实验小组对一含有Al3+的未知溶液进行了如下分析:| A. | 该未知溶液中一定含有Al3+ Mg2+ H+三种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5 mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g | |
| D. | 若另一种离子为二价阳离子,则a=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com