
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| A、中和一定的NaOH溶液,需消耗与NaOH等物质的量的HA |
| B、将pH=4的HA溶液稀释10倍,溶液pH小于5 |
| C、将pH=2的HA溶液与pH=12的NaOH溶液等体积混合后,溶液呈酸性 |
| D、将0.1mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
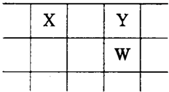 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电力 | B、核能 | C、太阳能 | D、氢能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质名称 | 颜色、气味 | 熔点(℃) | 沸点(℃) | 25℃水中溶解度(g/L) | 标况下密度 (g/L) |
| NH3 | 无色、刺激性 | -77.7 | -33 | 456 | 0.6942 |
| H2 | 无色、无味 | -259.2 | -253 | 0.0015 | 0.0899 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
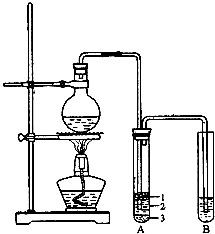 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com