
| A. | 明矾净水原理为:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 该溶液中AlO2-、F-、K+、Na+能大量共存 | |
| C. | 加入过量NH3•H2O反应的离子方程式为:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 加入过量Ba(OH)2溶液反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+=AlO2-十2BaSO4↓+2H2O |
分析 A.铝离子水解生成氢氧化铝胶体,不能使用沉淀符号;
B.偏铝酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀;
C.氨水为弱碱,反应生成氢氧化铝沉淀;
D.氢氧化钡过量,反应生成偏铝酸根离子和硫酸钡沉淀.
解答 解:A.明矾中铝离子发生水解生成氢氧化铝胶体,正确的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故A错误;
B.AlO2-与明矾中铝离子发生双水解反应生成氢氧化铝沉淀,在溶液中不能大量共存,故B错误;
C.一水合氨与明矾溶液中的铝离子发生反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.加入过量Ba(OH)2溶液,铝离子转化成偏铝酸根离子,反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+=AlO2-十2BaSO4↓+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型离子化合物 | |
| D. | W的单质有毒,能使湿润的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
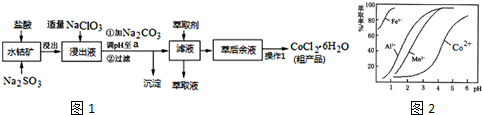
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g冰的晶体中含有氢键的数目为2 NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA | |
| D. | 1 mol C12与足量NaOH溶液反应,转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.
X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种含氧官能团 | |
| B. | 可发生取代、加成、消去、加聚等反应 | |
| C. | 该物质的分子式为C10H10O6 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将盛少量水的分液漏斗静置、倒置、将塞子旋转1800后再次倒置 | 漏斗口和活塞不漏水 | 分液漏斗不漏液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醇都能发生催化氧化、消去反应 | |
| B. | 低级醇(甲醇、乙醇、丙醇、乙二醇)都能与水以任意比互溶 | |
| C. | 凡烃基直接和羟基相连的化合物一定是醇 | |
| D. | 乙醇和浓硫酸按1:3体积比混合、共热就一定产生乙烯. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com