
| A. | SO2、Cl2、H2S | B. | O2、H2、SO2 | C. | NO、H2、O2 | D. | CO、NH3、O2 |
分析 气体之间不发生化学反应就能共存;浓硫酸是酸能和碱性气体发生反应,浓硫酸有强氧化性能与强还原性的气体反应,所以浓硫酸能干燥酸性气体或中性气体.
解答 解:A.SO2、Cl2、H2S三种气体之间,Cl2和H2S能发生反应,且H2S能被浓硫酸氧化,不能用浓硫酸干燥,故A错误;
B.H2、O2、SO2三种气体之间不发生反应,且这三种气体和浓硫酸不反应,所以能共存且能用浓硫酸干燥,故B正确;
C.NO、H2、O2三种气体,NO和O2之间能发生反应,不能共存,故C错误;
D.CO、NH3、O2三种气体之间不发生反应,但氨气是碱性气体,能和浓硫酸反应,所以氨气不能用浓硫酸干燥,故D错误;
故选B.
点评 本题考查了气体的共存与干燥,题目难度不大,明确常见气体的性质为解答关键,注意浓硫酸不能干燥碱性气体和强还原性的气体,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①② | C. | ①②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
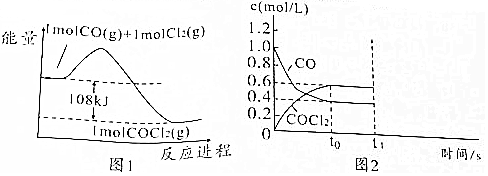
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯是纯净物,聚乙烯是混合物,都能使酸性KMnO4溶液褪色 | |
| B. | 取等质量的乙烯和和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 常温下乙烯为气态,聚乙烯为固态 | |
| D. | 乙烯可以发生加成聚合反应生成聚乙烯,聚乙烯的单体是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应X+Y=M是放热反应,该反应一定不用加热 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 酸与碱的中和反应是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 →
→
| A. | 香茅醛能使Br2的CCl4溶液褪色 | |
| B. | 青蒿素分子中含有酯基和醚键等官能团 | |
| C. | 青蒿素在一定条件下可发生水解反应 | |
| D. | 二者均可与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题.
电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题.查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 浓硝酸和稀硝酸都具有强氧化性 | 浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色 |
B | 浓硫酸具有强氧化性和吸水性 | 浓硫酸可干燥H2和CO,不可干燥 SO2和NH3 |
C | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
D | 铵盐受热易分解 | NH4Cl和NH4HCO3均可用作氮肥和制取氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com