
| A. | 澄清的石灰水,浓硫酸 | B. | 浓硫酸,溴水 | ||
| C. | 溴水,浓硫酸 | D. | 浓硫酸,酸性KMnO4溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA | |
| C. | 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| D. | 标准状况下,22.4L苯中C-H键数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 路线:
路线:
 .
.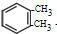 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$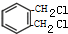 +2HCl
+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (一)实验方法测定反应热---------中和热测定
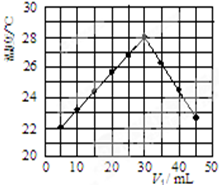
(一)实验方法测定反应热---------中和热测定| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1Cl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
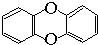 ,其一氯代物有( )
,其一氯代物有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com